齐默尔曼重排反应
齊默爾曼重排反应(Zimmermann rearrangement),亦称二-π-甲烷重排反应(Di-pi-methane rearrangement),指1,4-二烯光促转化为烯基环丙烷的反应。[1]它是一种光化学反应,在光反应条件(hv)下发生于含有两个π电子体系且被一个饱和碳原子分开的分子实体中(通常为1,4-二烯或烯丙基芳环),产物为烯基或芳基取代的环丙烷。该重排相当于二烯中的一个烯基或芳基发生了1,2-迁移,并在未迁移部分的两个不动的碳原子间形成了一根σ共价键。[2][3]
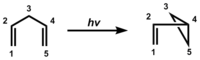
发现及机理
[编辑]该重排反应最早在桶烯光解得到半瞬烯的反应中被观测。[4] 1967年反应机理被霍华德·齐默尔曼表征。由于清晰地了解到该反应的结构要求(一个sp3杂化的碳原子上连接有两个π体系),其后一段时间有更多的反应实例被研究者们获得。其中一个典例是Mariano二烯(3,3-二甲基-1,1,5,5-四苯基-1,4-戊二烯)的光解反应。[5][6][7] 另一个典例是关于Pratt二烯的反应。 [8]

不同的是,在Pratt二烯重排中存在两种可能的区域选择性,图示路径a为优势反应,因为单电子在苯基的共轭作用下更加稳定。

桶烯的重排机理业已提出,由于桶烯中存在两个sp3杂化的桥头碳原子,且每个桥头碳连接有3个π体系(乙烯类),其中两个用于齊默爾曼重排,故该机理较以上两个例子更显复杂。另外,桶烯处于三重态,而Mariano二烯和Pratt二烯的处于单重态,故桶烯重排用丙酮作为光捕捉和传递剂(促使反应发生)。重排最后一步发生了系际交叉跃迁(ISC)以将单电子翻转至合理状态来形成一个新的σ键。

齊默爾曼重排反应的成功取决于三重态和单重态间主要展现的自由旋转效应(Free-Rotor Effect)。[9]
齊默爾曼重排反应禁阻的三重态无环1,4-二烯可以经双键的顺反异构化,即通过扭曲减弱π键,而转变为允许发生反应的单重态(不旋转)。对环状1,4-二烯而言,如上述桶烯,环结构阻止了顺反异构化,故发生齊默爾曼重排需要额外的光捕捉和传递剂(丙酮)。
参见
[编辑]参考文献
[编辑]- ^ Jie Jack Li. Name Reactions Fifth Edition. Springer. 2014-09-30: 654~655. ISBN 978-3-319-03978-7.
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "di-π-methane rearrangement"。doi:10.1351/goldbook.D01745
- ^ Zimmerman, Howard E.; Armesto, Diego. Synthetic Aspects of the Di-π-methane Rearrangement. Chemical Reviews. 1996, 96 (8): 3065–3112. PMID 11848853. doi:10.1021/cr910109c.
- ^ Zimmerman, H. E.; Grunewald, G. L. The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. J. Am. Chem. Soc. 1966, 88 (1): 183–184. doi:10.1021/ja00953a045.
- ^ Zimmerman, Howard E.; Binkley, Roger W.; Givens, Richard S.; Sherwin, Maynard A. Mechanistic organic photochemistry. XXIV. The mechanism of the conversion of barrelene to semibullvalene. A general photochemical process. Journal of the American Chemical Society. 1967, 89 (15): 3932–3933. ISSN 0002-7863. doi:10.1021/ja00991a064.
- ^ Zimmerman, H. E.; Mariano, P. S. The Di-pi-Methane Rearrangement. Interaction of Electronically Excited Vinyl Chromophores. J. Am. Chem. Soc. 1969, 91: 1718–1727. doi:10.1021/ja01035a021.
- ^ Hixson, Stephen S.; Mariano, Patrick S.; Zimmerman, Howard E. Di-pi-methane and oxa-di-pi-methane rearrangements. Chemical Reviews. 1973, 73 (5): 531. doi:10.1021/cr60285a005.
- ^ Zimmerman, H. E.; Pratt, A. C. Unsymmetrical Substitution and the Direction of the Di-pi-Methane Rearrangement; Mechanistic and Exploratory Organic Photochemistry. LVI. J. Am. Chem. Soc. 1970, 92: 6259–6267. doi:10.1021/ja00724a026.
- ^ Zimmerman, H. E.; Schissel, D. N. Di-pi-Methane Rearrangement of Highly Sterically Congested Molecules; Inhibition of Free Rotor Energy Dissipation. Mechanistic and Exploratory Organic Photochemistry. J. Org. Chem. 1986, 51: 196–207. doi:10.1021/jo00352a013.
