三氯化六氨合钴
| 三氯化六氨合钴(III) | |
|---|---|
| |

| |
| IUPAC名 Hexaamminecobalt(III) chloride 三氯化六氨合钴(III) | |
| 识别 | |
| CAS号 | 10534-89-1 |
| SMILES |
|
| 性质 | |
| 化学式 | H18N6Cl3Co |
| 摩尔质量 | 267.48 g/mol g·mol⁻¹ |
| 外观 | 黄色或橙黄色晶体 |
| 密度 | 1.71 g/cm3, |
| 熔点 | 加热分解 |
| 溶解性(水) | 0.26M (20℃) 三溴化物:0.04M (18℃) |
| 溶解性(其他溶剂) | 可溶于氨水 |
| 结构 | |
| 配位几何 | 八面体 |
| 偶极矩 | 0 D |
| 危险性 | |
| 警示术语 | R:36/37/38 |
| 安全术语 | S:none |
| 主要危害 | 有毒 |
| 相关物质 | |
| 其他阴离子 | [Co(NH3)6]Br3 [Co(NH3)6](OAc)3 |
| 其他阳离子 | [Cr(NH3)6]Cl3 [Ni(NH3)6]Cl2 |
| 相关化合物 | [Co(H2NCH2CH2NH2)3]Cl3 [Co(NH3)5(H2O)]Cl3 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
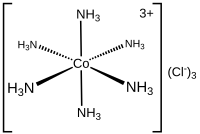
三氯化六氨合钴的分子式为[Co(NH3)6]Cl3,是一种典型的维尔纳配合物。该配合物是由一个[Co(NH3)6]3+阳离子和三个Cl-组成的。
结构和性质
[编辑][Co(NH3)6]Cl3是反磁性的,低自旋的钴(III)处于阳离子八面体的中心。由于阳离子符合18电子规则因此被认为是一例典型的对配体交换反应呈惰性的金属配合物。作为其对配体交换反应呈惰性的一个体现,[Co(NH3)6]Cl3中的NH3与中心原子Co(III)的配位是如此的紧密,以至于NH3不会在酸溶液中发生解离和质子化,使得[Co(NH3)6]Cl3可从浓盐酸中重结晶析出[1][2]。与之相反的是,一些不稳定的金属氨络合物比如[Ni(NH3)6]Cl2,Ni(II)-NH3键的不稳定使得[Ni(NH3)6]Cl2在酸中迅速分解。三氯化六氨合钴经加热后会失去部分氨分子配体,形成一种强氧化剂。
三氯化六氨合钴中的氯离子可被硝酸根、溴离子和碘离子等一系列其他的阴离子交换形成相应的[Co(NH3)6]X3衍生物。这些配合物呈亮黄色并显示出不同程度的水溶性。
合成方法
[编辑]由于CoCl3是不存在的,所以三氯化六氨合钴的合成都是以二价钴盐的水合物为原料合成的,二价钴盐的水合物可以是CoCl2[1]、Co(NO3)2[2]等。用氨水和铵盐配成的氨性溶液和二价钴盐的水溶液反应形成[Co(NH3)6]2+随后将其氧化,在盐酸溶液中经重结晶处理后得到产物。合成步骤中的氧化反应是在以活性碳作为催化剂、过氧化氢或氧气为氧化剂的条件下进行的:[1][3]
- 4CoCl2 + 4NH4Cl+ 20NH3 + O2 → 4[Co(NH3)6]Cl3 + 2H2O
[Co(NH3)6]3+的乙酸盐是由Co(OAc)2、乙酸铵和氨在甲醇溶液中通过氧气氧化制备的,你也可以在含有六氨合钴的溶液中加入过量乙酸来制备该盐。[4][Co(NH3)6](OAc)3有很好的水溶性,20℃时的溶解度达到1.9M而同一温度下三氯化六氨合钴的溶解度只有0.26M。
用途
[编辑]三氯化六氨合钴是合成其它一些Co(III)配合物的原料。[5][2]
参考资料
[编辑]- ^ 1.0 1.1 1.2 Jannik Bjerrum, James P. McReynolds, Alfred L. Oppegard, R. W. Parry. Hexamminecobalt(III) Salts. Inorg. Synth. 1946, 2: 216–221. doi:10.1002/9780470132333.ch69.
- ^ 2.0 2.1 2.2 J. A. Baur , C. E. Bricker. Hexamminecobalt(III) Tricarbonatocobaltate(III)-A New Analytical Titrant. Anal. Chem. 1965, 37 (12): 1461–1464. doi:10.1021/ac60231a005.
- ^ J. Bjerrum. Metal Ammine Formation in Aqueous Solution. Copenhagen: P. Haase and Son. 1941: 241.
- ^ Lindholm, R. D.; Bause, Daniel E. Hexamminecobalt(III) Salts. Inorg. Synth. 1978, 18: 67–69. doi:10.1002/9780470132494.ch14.
- ^ R. W. Parry , D. R. Schultz , P. R. Girardot. The Preparation and Properties of Hexamminecobalt(III) Borohydride, Hexamminechromium(III) Borohydride and Ammonium Borhydride. J. Am. Chem. Soc. 1958, 80 (1): 1–3. doi:10.1021/ja01534a001.
