西方墨點法

西方墨點法(英語:Western blot)或稱「蛋白質轉漬法」、「免疫墨點法」(immunoblot)或「西式吸印雜交」,是在分子生物学、生物化学和免疫遗传学中常用的一种实验方法,也是HIV檢測的方法之一。
利用特定抗體能夠專一結合其抗原蛋白質的原理來對樣品進行着色,通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中的表达情况的信息,來分析檢測特定蛋白質的生物學檢測技術。
发明者一般认为是美国斯坦福大学的乔治·斯塔克(George Stark)。[1]在尼尔·伯奈特(Neal Burnette)于1981年所著的《分析生物化学》(Analytical Biochemistry)中首次被称为“Western印迹法”。
原理
[编辑]Western Blot与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE(根據分子大小)分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。
實驗步驟
[编辑]實驗大致分為鑄膠、跑膠、轉漬、接一級抗體、接二級抗體以及壓片幾個部分。
组织准备
[编辑]样本可以从整个组织或者细胞培养物中获得。固体组织首先需要被机械性的破碎,可以使用搅拌器(对于较大体积的样本),匀质机(对于小体积的样本),或者利用超声波粉碎。细胞也可以通过上述方式机械性的被破开。当然病毒及环境样本也可以是蛋白的来源,因此Western Blotting并不仅限于细胞研究。
合适的清洁剂、盐类和Buffer都可以被用于裂解细胞以及溶解蛋白。蛋白酶和磷酸酶抑制剂经常被添加进去,以防护样品被其自身的酶消化掉。组织准备经常在低温条件下进行,以避免蛋白变性和降解。
生物化学与机械技术(包括各种形式的过滤和离心)的结合,可用于分离不同的细胞室与细胞器。

凝膠電泳
[编辑]样本中的蛋白质通过凝胶电泳进行分离。蛋白质可以通过等电点(pl),分子量,电荷,以及上述因素的组合进行分离。分离的实际效果取决于样本的处理和凝胶的性质。这是用来识别某种蛋白的一个非常有用的方法。
到目前为止,最常见的凝胶电泳方式是采用聚丙烯酰胺凝胶和十二烷基硫酸钠(SDS)作为缓冲负载的组合。SDS-PAGE(SDS聚丙烯酰胺凝胶电泳)能够保存处在变性状态下的多肽,这些多肽由蛋白质被强还原剂还原而失去了二三级结构产生(例:从二硫键[S-S]到巯基[SH and SH]),通过他们不同的分子量,从而将蛋白质分离。采样蛋白被带负电荷的SDS包裹,并通过凝胶的丙烯酰胺网格移动到带正电的电荷上。较小的蛋白质会更快的迁移通过这个网格,因此蛋白质是通过大小(通常用千道尔顿,kDa作为量度单位)进行分离的。丙烯酰胺浓度决定了凝胶的分辨率:丙烯酰胺浓度越大,较低分子量的蛋白质的分辨率越好。丙烯酰胺浓度越低,高分子量的蛋白质的分辨率越好。蛋白质通常在凝胶上只沿一维做线性运动形成印痕。
样品被加载到凝胶的泉点。第一道通常是预留给标记物或者梯度物的,它们是一些市售的蛋白质混合物,具有标定的分子量,能形成典型可见的彩色染色条带。当电压被施加在凝胶上,蛋白质透过其以不同的速度进行迁移,取决于蛋白质的大小。这些不同的前进速率(不同的电泳迁移率)在每个道内单独形成条带。

它也可以使用两维(2-D)的凝胶,蛋白质从一个单一样品中沿两个维度传播。蛋白质按等电点(蛋白质解离成阴阳离子的趋势或程度相同,使得净电荷成中性,此时的pH值即为等电点)在第一个维度分离,并根据其分子量在第二个维度中分离。
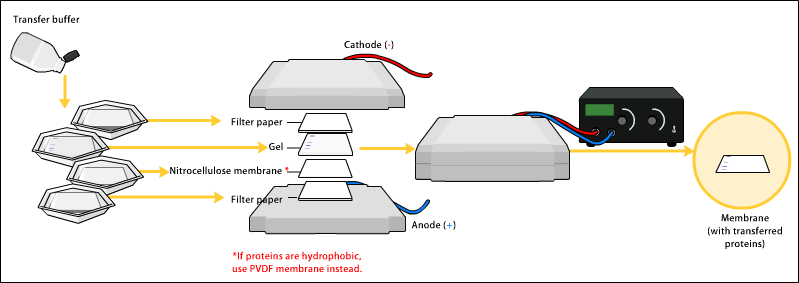
轉漬
[编辑]要讓抗體成功對蛋白質產生反應,就要將蛋白質从凝胶中转移到用硝化纤维或聚偏二氟乙烯(PVDF)製成的膜。轉漬蛋白質時,最常用的方法稱爲"电印迹"(Electroblotting),即運用電流,從凝膠中牽引出帶負電荷的蛋白質,使其向帶正電荷的陽極方向移動,進入PVDF或硝化纖維膜內。蛋白質自凝膠移入膜內時,可維持其在凝膠內形成的結構。較舊的轉漬方法,則是在凝膠上先放一塊膜,再放一疊濾紙,然後,將其整疊移至緩衝溶液中,溶液在毛細管作用下會帶動蛋白質,一同由下而上進入濾紙。但實際上由於耗時長,該方法並不常用。 不論採用何種方法,轉漬完成後,蛋白質便會顯露於薄膜上,可供檢測。
封闭
[编辑]由于膜能结合蛋白质,所以抗体以及目标蛋白都可以结合到膜上,也因此我们必须防止膜和抗体的反应发生。把膜放在稀释的蛋白质溶液中(比如3-5%的牛血清蛋白、脱脂牛奶、TBS或者I-Block)可以阻挡非特定的结合。稀释溶液中的蛋白会把膜上没有与目标蛋白结合的地方全部结合,因此加了抗体之后,膜上就没有空间去结合其他非目标蛋白。阻拦是实验最后的铺垫,可以使结果更清晰,排除错误可能性。
检测
[编辑]在检测过程中,使用被修饰的抗体作“探针”来标记膜上的目标蛋白,这一抗体与报告酶相连接。当暴露于适当的底物时,报告酶驱动比色反应并产生颜色。由于各种原因,这传统上发生在一个两步法的过程中,虽然现在某些应用中可以用一步法的检测方法。
一级抗体(一抗)
[编辑]当宿主或免疫细胞培养物暴露于目标蛋白(或其一部分)时,产生一抗。通常这是免疫反应的一部分,而在这里一抗被采集,并在 Western blot 实验中被用作直接结合蛋白质的敏感的和特异性的检测工具。
在封闭后,将使用PBS或TBST缓冲液稀释后的一抗溶液(通常0.5-5mg/mL)在温和搅拌下与膜培育,通常室温下培育1小时,或4℃下培育过夜。也可在不同温度下培育,较低的温度常带来更高的结合性,包括特异性(与"目标蛋白")与非特异性(与"噪声")结合。培育后,将膜在洗涤缓冲液中洗涤数次以除去未结合的一抗,使背景最小化。通常,洗涤缓冲液包括含少量洗涤剂的缓冲盐液,有时加入奶粉或BSA。
二级抗体(二抗)
[编辑]冲洗膜以除去未结合的一抗,然后将膜暴露于另一种抗体,称之为二抗。抗体来源于动物(或动物源的杂交瘤培养物)。二抗识别并结合一抗的物种特异性位点。因此,一个抗小鼠二抗可以与任何小鼠来源的一抗结合,并且可被称为“抗物种”抗体(如抗小鼠,抗山羊等)。为了检测靶蛋白,二抗通常与生物素或报告酶结合,如碱性磷酸酶、辣根过氧化物酶。这意味着几种二抗可与一种一抗结合并增强信号,从而可以检测比单独SDS-PAGE凝胶电泳所见浓度更低的蛋白质。
辣根过氧化物酶(Horseradish peroxidase, HRP)通常与二抗结合,以允许通过化学发光检测靶蛋白。化学发光底物被HRP裂解,产生发光。因此,发光的量与HRP结合的二抗的量成正比,从而可以间接检测靶蛋白的存在。将敏感的摄影胶片置于膜上,暴露于反应产生的光,可以产生与印迹结合的抗体的图像。更便宜但不太敏感的方法是使用含1%过氧化氢的4-氯萘酚染色剂,过氧化物自由基与4-氯萘酚反应产生深紫色斑点,可以在不使用专门胶片的情况下拍摄。
另一种二抗检测方法利用了近红外(near-infrared, NIR)荧光团结合的抗体。由荧光染料激发产生的光是静态的,使得荧光检测更更清晰和精确地测量 Western blot 中与蛋白结合的标记抗体产生的信号。蛋白质可以被精确测量,是因为膜上由不同蛋白量产生的信号是静态测量的,而化学发光检测的光是动态测量的。
第三种选择是使用放射性标记而不是与二抗结合的酶,例如使用碘的放射性同位素标记抗体结合蛋白,如葡萄球菌蛋白A或抗生蛋白链霉菌素。由于其他方法更安全、快捷、便宜,现已很少使用这种方法。然而,该方法的一个优点是基于自动射线的成像的灵敏度,在光学软件的帮助下,可以实现高精度的蛋白定量检测。
两步法
[编辑]
一步法
[编辑]历史上,由于在不同过程中获得一抗和二抗相对容易,探测过程通常采用两步法。这为研究人员和公司在灵活性、缩减成本方面提供了巨大优势,也为检测过程增加了扩增步骤。然而,由于高通量蛋白分析和低检测限的出现,人们对发展一步法探测系统产生兴趣,这一系统将加快检测进程,并减少消耗。这需要一种探针抗体,既能识别靶蛋白,又含有可检测的标记,探针通常可用于已知的蛋白标签。与两步法中的一抗类似,初级探针与膜一起培育,然后在一些列洗涤步骤后可以直接检测。

分析
[编辑]在未结合的探测剂被洗去之后,西方墨点法准备好检测被标记和结合到目标蛋白质的探测剂。在实际应用中,并不是所有的西方墨点法揭示蛋白质仅在一种膜上的一个条带。
双向凝胶电泳
[编辑]双向凝胶电泳也有用于上述的结果测定的前景。在2-D SDS-PAGE中,多肽链在二维平面上迁移。比如说,在第一个维度上,多肽根据其等电点被分离。而在第二个维度上,多肽链根据其分子质量分离。一个已知蛋白的等电点由其带正电氨基酸(如赖氨酸、精氨酸)与带负电氨基酸(谷氨酸、天冬氨酸)的相对数量决定。样品可以先在非还原性条件下由SDS-PAGE分离,之后在还原性条件下做双向电泳,后者会打破使蛋白质亚基连接的二硫键。
原则上,这个方法可以做到在一个凝胶中分离所有细胞蛋白。它主要的优势即在于它往往能区分不同特定蛋白的多个亚种,比如区分一个蛋白是否被磷酸化。被分离的蛋白可以从凝胶中切除并后续使用质谱法确定分子质量。
分类
[编辑]Western Blot显色的方法主要有以下几种:
- 放射自显影
- 底物化学发光ECL
- 底物荧光ECF
- 底物DAB呈色
现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。
应用
[编辑]Western印迹法在生物化学中定性检测单个蛋白与蛋白修饰(比如翻译后修饰PTM)中有着广泛的应用。据估计,至少8-9%的与蛋白相关的出版物都应用了Western印迹法[2]。他被用作为一种可以鉴别在蛋白混合物中鉴别单种蛋白的泛用方法。并且通过蛋白与印迹膜上蛋白带的大小与颜色可以得到一个半定量的估计。除此以外,应用在一组经过梯度稀释已知浓度的纯化蛋白可以获得更加精确的蛋白浓度。Western印迹法被常规用作蛋白克隆后的鉴定实验,也被广泛用于药物诊断,比如HIV诊断和牛海绵状脑病(通常所说的疯牛病)检测。
在HIV检测试验种,应用Western印迹法检验在人体血清中的抗HIV抗体。已知被HIV感染的细胞被分散的点在向上面描述的膜上。随后,血清在一级抗体中培育;洗去自由的未结合抗体,并加入与一个酶信号连接的二级抗体。显色的板子就会表示出病人的血清中很有抗体[3]。Western印迹法也被用在诊断变异型克雅二氏病中,这是一种由于食用患有牛海绵状脑病的牛肉所引起的朊毒體疾病。
另一个应用是用于的兔热病诊断中。Western印迹法检测针对土伦病法兰西斯氏菌的敏感度几乎达到100%,而专一性也达到了99.6%。[4]
Western印迹法进一步的应用也包括世界反兴奋剂组织的赛后检测等等。
參見
[编辑]- 南方墨點法
- 北方墨點法
- 十二烷基硫酸鈉聚丙烯酰胺凝膠電泳-简称SDS-PAGE
参考文献
[编辑]- ^ Alwine J, Kemp D, Stark G,. Method for detection of specific RNAs in agarose gels by transfer to diazobenzyloxymethyl-paper and hybridization with DNA probes.. Proceedings of the National Academy of Sciences USA. 1977, 74 (12): 5350–5354. PMC 431715
 . PMID 414220. doi:10.1073/pnas.74.12.5350.
. PMID 414220. doi:10.1073/pnas.74.12.5350.
- ^ Moritz, Christian P. 40 years Western blotting: A scientific birthday toast. Journal of Proteomics. 2020-02-10, 212 [2022-11-19]. ISSN 1876-7737. PMID 31706026. doi:10.1016/j.jprot.2019.103575. (原始内容存档于2022-02-15).
- ^ Lakshmi, V; Teja, Vd; Sudha, T. Western blot profile in HIV infection. Indian Journal of Dermatology, Venereology and Leprology. 2006, 72 (5) [2022-12-17]. ISSN 0378-6323. doi:10.4103/0378-6323.27752. (原始内容存档于2020-02-13) (英语).
- ^ Schmitt, P.; Splettstösser, W.; Porsch-Özcürümez, M.; Finke, E.-J.; Grunow, R. A novel screening ELISA and a confirmatory Western blot useful for diagnosis and epidemiological studies of tularemia. Epidemiology and Infection. 2005-02-16, 133 (4). ISSN 0950-2688. doi:10.1017/S0950268805003742 (英语).
