p轨道
在化学与原子物理学中,p轨域(英语:p orbital)是一种原子轨域,其角量子数为1,其磁量子数可以为-1、0或+1,且每个壳层里中有三个p轨域,Px、Py、Pz,形状皆相同但方向不同,每个可以容纳2个电子,因此,p轨域共可以容纳6个电子。
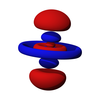
p轨域是一个很稳定的轨域,其稳定性仅次于s轨域,为能量第二低的轨域,另外由于能阶交错,若以周期的角度来看,p轨域是能量最高的轨域,也是最后填满的轨域,其电子出现机率密度的形象是哑铃形,呈线性对称,换句话说,p轨域是一个双哑铃形或吊钟形的轨域。
命名[编辑]
p轨域的“p”是“principal”,其为“主系光谱”之意。
结构[编辑]


p轨域从第二个壳层开始出现,最小的p轨域是2p轨域,也就是说,当主量子数n=1时,没有p轨域(1p轨域不存在)。当角量子数l=1时,磁量子数m会有三种值,分别为1、0、-1,因此,自量子数n=2开始有三种p轨域对应于每一个主量子数,例如,当主量子数n=2时,p轨域分别为2px、2py和2pz轨域,每个轨域皆可分成两叶,带有不同的“正负性”,这是代表波函数量值的正负。大小则如同s轨域,p轨域的形状在2p、3p、4p里都相同,只是大小随著主量子数的增加而增加。p轨域同样存在波节面,如3p轨域在主要电子出现的两叶中,有较小而与主叶分离的区域,此处电子出现概率为0,则这个区域即为p轨域的波节面,随著主量子数的增加,波节的数量也会跟著增加。
电子波[编辑]
三个p轨域的原子轨域角量子数ℓ=1。p轨域的三次谐波的表示法:
with
| pz | px | py |
|---|---|---|
 |
 |

|
p轨域[编辑]
在周期表中,每个周期元素的价壳层,p轨域是最后才填满的轨域,直至18族,p轨域是全满的。
p区元素[编辑]
p区元素是指元素周期表中13族至18族的元素(氦除外)。这些元素其新增加的电子皆填入p轨域,故称该区块为p区。周期表中从第2周期开始的每个周期都各有6个p区元素。
参见[编辑]
参考文献[编辑]
- 曾国辉《原子结构》建宏出版社 台北市 1999 ISBN 957-724-801-2
| |||||||||||||||||||||||||||||||