磷的含氧酸
磷的含氧酸是任何由分子磷、氧和氫原子組成的酸的統稱。[1]這類化合物的數量可能是無限的。有些是不穩定且仍未分離的,但所衍生的陰離子和有機官能團存在於穩定的鹽和酯中。在生物學、地質學、工業和化學研究中,最重要的是磷酸,其酯和鹽是磷酸鹽。
一般地,任何與氧原子鍵合的氫原子都是酸性的,所以–OH基會失去一個質子H+
並留下帶負電荷的–O−
基,從而將酸轉化為磷的含氧陰離子。每個額外丟失的質子都有一個相關的酸度係數Ka1、Ka2、Ka3 等,通常用其余對數表示(pKa1、pKa2、pKa3等 )。直接與磷鍵合的氫原子通常不是酸性的。
分類
[編輯]磷的含氧酸可以根據磷原子的氧化態(從+1到+5不等)分類。氧原子的氧化態通常是-2,但如果分子含有過氧基,則它的氧化態可以是-1。
氧化態+1
[編輯]氧化態+3
[編輯]氧化態+4
[編輯]氧化態+5
[編輯]這一類中最重要的酸是磷酸,其中每個磷原子與四個氧原子鍵合,之中有一個有雙鍵,以四面體的角的形式排列。兩個或多個PO
4四面體可以通過共同使用的單鍵氧連接,形成直鏈、支鏈、環或更複雜的結構。不共同使用的單鍵氧原子由酸性氫原子鍵合。它們的通式是Hn-x+2PnO3n-x+1 ,其中n是磷原子的數量, x是分子結構中的循環基底。
這些酸及其酯和鹽(磷酸鹽)包括一些最著名和最重要的磷化合物。
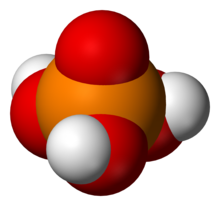
3PO
4。
這一類中最簡單的酸是
這一類中具有兩個或多個磷原子的最小化合物稱為「低聚磷酸」,具有直鏈–P–O–主鏈的較大化合物稱為「多聚磷酸」。兩者之間沒有明確的區別。一些最重要的酸是:
- 焦磷酸,H
4P
2O
7(或 (HO)
2P–O–P(OH)
2),具有四個酸氫原子。形成焦磷酸鹽。 - 三聚磷酸, H
5P
3O
10(或(HO)
2P–O–P(OH)–O–P(OH)
2),具有五個酸性氫原子。形成三磷酸鹽。 - 四聚磷酸,H
6P
4O
13(或(HO)
2P(–O–P(OH))2–O–P(OH)
2),具有六個酸性氫原子。形成四磷酸鹽。
主鏈可以是分支的,如
- 三亞磷酸磷酸,H
6P
4O
13或P(O)(–OP(O)(OH)
2)3,四聚磷酸的支鏈異構體。
PO
4四面體可以連接形成閉合的-P-O-鏈,如
偏磷酸是含有一個環((–P(O)(OH)–O–)n)的磷酸的統稱,其分子式為HPO
3。
-
四聚磷酸
H6P4O13
另一個可以屬於這一類的化合物是
多種氧化態
[編輯]一些磷的含氧酸具有兩個或多個氧化態不同的磷原子。其中一個酸是
- 連二磷(III, V) 酸,H
4P
2O
6(或H(OH)(O)P−O−P(O)(OH)2),一種四元酸,是次磷酸的異構體,其中的磷原子的氧化態為+3和+5

P4O10

參見
[編輯]進階閱讀
[編輯]- Polyphosphate in bone (PDF). Biochemistry (Moscow). Mar 2000, 65 (3): 296–303. (原始內容 (PDF)存檔於2011-08-25).
外部鏈接
[編輯]- Determination of Polyphosphates Using Ion Chromatography with Suppressed Conductivity Detection, Application Note 71 by Dionex
- US 3044851,Young, Donald C.,「Production of ammonium phosphates and product thereof」,發表於1962-07-17
- 醫學主題詞表(MeSH):Phosphorus+Acids
參考文獻
[編輯]- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.