亚硝酸甲酯
| 亚硝酸甲酯 | |
|---|---|
| |
| 识别 | |
| CAS号 | 624-91-9 |
| PubChem | 12231 |
| ChemSpider | 11730 |
| SMILES |
|
| InChI |
|
| InChIKey | BLLFVUPNHCTMSV-UHFFFAOYAL |
| 性质 | |
| 化学式 | CH3NO2 |
| 摩尔质量 | 61.04 g·mol−1 |
| 熔点 | -16 °C(257 K) |
| 沸点 | -12 °C(261 K) |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
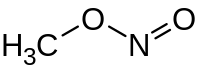
亚硝酸甲酯(Methyl nitrite)是一种有机化合物,化学式为,是结构最简单的亚硝酸酯,标准状态下为气态。
结构原理
[编辑]亚硝酸甲酯据有顺式与反式构象异构物,顺式及反式的结构可由光谱学来识别。顺式异构物比反式的要稳定,其旋转活化能为 45.3 kJ mol−1[1]。
 |
 |
合成
[编辑]亚硝酸甲酯可由亚硝酸银和碘甲烷的化学反应制作而成:亚硝酸银在溶液中会解离为Ag+以及NO2−。亚硝酸根中氧原子的孤电子对会让亚硝酸根攻击甲基(—CH3),释放碘离子到溶液中[2]。
碘化银和亚硝酸银不同,碘化银几乎不溶于水,在水中会形成固体[3]。氮比氧更为亲核,大部分亚硝酸盐会进行类似SN2的反应,主产品为硝基甲烷。例如亚硝酸钠和亚硝酸钾和碘甲烷反应后主要产物是硝基甲烷,亚硝酸甲酯只是次要产物。不过因为溶物中银离子的存在可以稳定碳正离子反应中间体的形成,增加亚硝酸甲酯的产率。不管是哪一种情形,都多少会生成一些硝基甲烷及亚硝酸甲酯。
亚硝酸甲酯会在无铅汽油燃烧时产生,可能会减少昆虫,欧洲的家麻雀及其他鸣禽的数量[4]。
香烟烟雾中存在亚硝酸甲酯,由一氧化二氮形成,而一氧化二氮是由一氧化氮及甲醇的自氧化所形成[5]。
性质及用途
[编辑]亚硝酸甲酯是氧化剂,也是热敏性的炸药。若有金属氧化物存在,会提高其热敏性。亚硝酸甲酯会和无机碱形成爆炸性的盐类。和空气也会形成易爆炸的混合物。亚硝酸甲酯可用作火箭推进剂,而且是单一推进剂[6]。亚硝酸甲酯比亚硝酸乙酯的爆炸威力更强,而碳链较短的亚硝酸酯即使放在冰箱内都很容易分解,并且爆破其容器[7]。
亚硝酸甲酯是有毒的窒息性气体,有可能会造成发绀。暴露在亚硝酸甲酯下可能会造成正铁血红蛋白血症[8]。
在化学合成(例如苯丙醇胺的制备)中,亚硝酸甲酯会作为前体及中间产物。
相关条目
[编辑]参考文献
[编辑]- ^ B.J. Van der Veken; R. Maas; G.A. Guirgis; H.D. Stidham; T.G. Sheehan; J.R. Durig. Infrared spectrum, ab initio calculations, barriers to internal rotation and structural parameters for methyl nitrite. Journal of Physical Chemistry. 1990, 94 (10): 4029–39. doi:10.1021/j100373a028.
- ^ Donald L. Pavia; Gary M. Lampman; George S. Kriz. Organic Chemistry 2. Mason, Ohio: Thompson Custom Publishing. 2004. ISBN 0-03-014813-8. OCLC 236055357.
- ^ Darrell D. Ebbing; Steven D. Gammon. General Chemistry 8th. Boston: Houghton Mifflin. 2005. ISBN 978-0-618-39941-3.
- ^ Summers-Smith, J. Denis. Is unleaded petrol a factor in urban House Sparrow decline?. British Birds. September 2007, 100: 558. ISSN 0007-0335.
- ^ Alan Rodgman; Thomas A. Perfetti. The Chemical Components of Tobacco and Tobacco Smoke, Second Edition. CRC Press. 19 April 2016: 827–. ISBN 978-1-4665-1552-9.
- ^ 存档副本. [2017-05-31]. (原始内容存档于2019-10-15).
- ^ L. Bretherick. Bretherick's Handbook of Reactive Chemical Hazards. Elsevier. 27 October 2016: 1501–. ISBN 978-1-4831-6250-8.
- ^ 存档副本. [2017-05-31]. (原始内容存档于2019-10-30).


