同芳香性

同芳香性(英语:homoaromaticity)在有机化学中是一种特殊的芳香性,一般指共平面的轮烯被sp3杂化的碳原子所隔断时产生的特殊芳香性。传统芳香性的定义认为这一类破坏了p轨道重叠的连续性且非共面的分子不具有芳香性,但却仍观察到此类物质具有相当大的热力学稳定性及与芳香族化合物相似的光谱、磁性和化学特性[1]。
同芳香性的概念最早由Saul Winstein于1959年提出,他在研究非经典碳正离子的报道里提及了这一名词[2]。迄今为止,已知的同芳香性化合物多以阳离子或阴离子的形式存在,关于中性同芳香性分子的研究较为罕见[3]。 环辛四烯在浓硫酸中被质子化产生的C8H9+离子[注 1],是研究最多的同芳香性阳离子。
历史
[编辑]命名
[编辑]同芳香性一词中的“同”源于其是衍生自共轭烯烃同系物的芳香性[2],含义是与对应的共轭烯烃结构有着相似的芳香性,IUPAC金皮书要求使用bis-、tris-等前缀来命名被二、三及更多个sp3碳所中断的对应共轭芳香物质,并在前冠homo-。
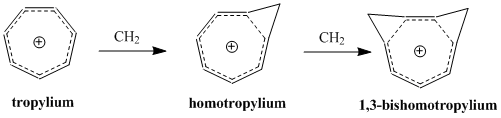
阐明
[编辑]同芳香性的发现源于1950年代对非经典碳正离子的争论,非经典碳正离子模型的支持者Saul Winstein在研究3-二环[3.1.0]己基阳离子时首次提出了同芳香性的概念。

在一系列的乙酰化实验中,Winstein等人观察到对甲苯磺酰基离去基团在位于分子赤道面时,经验上发现其溶剂解反应会发生的极快。该小组将反应速率的差异归因于顺式异构体引发的邻助效应,并借这一结论支持了非经典碳正离子结构的观点[4]。
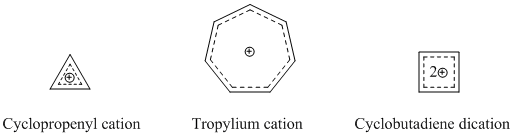
Winstein随后观察到,此类3-二环[3.1.0]己基阳离子模型与具芳香性的环丙烯阳离子类似——正电荷分散在三个含两个π电子的等效碳上。这种模型的电子数目满足休克尔规则,Winstein注意到环丙烯阳离子与非经典碳正离子的唯一区别在于,后者的共轭性被-CH2-单元所阻断。因此该小组提出了“三同环丙烯基[注 2]”这一物质,这是一种环丙烯阳离子所对应的具有同芳香性的同系物。
同芳香性的证明
[编辑]标准
[编辑]芳香性的判断标准随着科学进步和观点交换已经日臻完善,不过,对于芳香性分子所应具的标准条件仍是有争议的[5]。传统观点认为,具有符合休克尔规则的平面共轭系统是芳香族化合物的判断标准。此外,这些共轭的环状系统还需要拥有相较于普通共轭体系所不具有的高热化学稳定性和磁特征。简而言之,芳香族化合物的三个主要特征为[6]:
- 满足休克尔规则
- 高热化学稳定性
- 光谱和磁性特性
需要注意的是,芳香性的概念是用于对某一类化合物(即芳香化合物)的特殊稳定性的描述,而非表达某一理论的术语[7][注 3]。并且,芳香性的传统定义也存在许多例外情况,例如符合 Möbius体系的Craig模型[8]、周环过渡态分子、电子通过σ离域的分子、一些过渡金属夹心型配合物等都拥有类似芳香性的特征而不满足标准的先决条件[9]。
因此,同芳香性离域的标准也有些含糊和有待探讨。同䓬离子C
8H+
9虽然不是第一个被发现的同芳香性化合物,但却是相关研究最多的同芳香性化合物,也被认为是最经典的同芳香性代表物。至1980年代中期,已有40余种C
8H+
9衍生物的研究报道,可以说现在对于同芳香性的认知很多是基于C
8H+
9发展而来的[6]。
早期证明
[编辑]在Winstein发表同芳香性结构的初期研究后,引发了许多小组对类似结构物质的报告。其中最多的便是环辛四烯被强酸质子化后得到的阳离子,其母体最先由Pettit等人作为稳定的盐分离得到[10]。同芳香性的早期证明都是基于该物质的表征。
NMR
[编辑]通过1H NMR光谱表征环辛三烯阳离子时,Pettit小组观察到,其中一个亚甲基上的两个质子有着惊人化学位移值差距。

Pettit等人由此得出结论,环辛三烯基阳离子的经典结构一定是不正确的。相反,他们提出了二环[5.1.0]辛二烯基的结构,并认为环丙烷上的电子存在相当大的离域,以解释化学位移值的巨大差异。进一步考虑后,Pettit倾向于将该结构以同芳香性阳离子的结构表示,这种结构通过电子离域而非简单的“环丙烷结构”来解释其光谱差异性,并且六个π电子也是符合休克尔规则的。NMR的磁场可以在该离子中感应到环电流,解释了面内外质子特性的反常差异。Pettit等人也强调了该物质与具芳香性的䓬离子的相似性,将其描述为䓬离子的“同系对应物[注 4]”,这与Winstein所预测的同芳香性一致[10]。
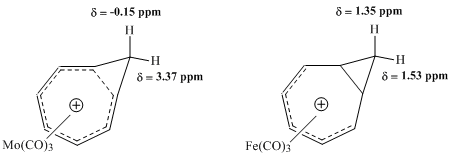
1965年,Winstein等人发表了对同䓬离子金属羰基配合物的NMR研究报告,其中钼与铁配合物的比较非常直观——三羰基钼预期通过接受六个π电子与环庚三烯阳离子配位,保留了配合物的同芳香性特征;相对的,三羰基铁仅接受了四个π电子配位,从而产生了定域电子的配合物。1H NMR光谱表征显示,钼配合物的对应亚甲基质子位移值存在很大的差异,而铁配合物中的位移值却相差甚微[11]。
UV
[编辑]紫外光谱也是早期证明同芳香性存在的重要证据之一。Winstein等人确定,与拥有环丙烷结构(和定域结构)的二环[5.1.0]辛二烯基或是经典结构的环辛三烯基阳离子相较有红移,其UV光谱类似于环庚三烯阳离子。进一步的计算使Winstein确定了与面外亚甲基相邻的两个碳原子之间的键级和䓬中的π键的键级相当[12]。尽管该实验有足够的启发性,但有观点认为UV光谱的计算数据不能作为关键的证据[6]。
近期证明
[编辑]近来有通过X射线衍射分析同䓬离子结构的研究,研究结果表明,该环丙烷结构的底部碳原子的核间距确实比普通的环丙烷分子更长,而面外的键长似乎更短,证明“环丙烷键”参与了环内的离域[6]。
分子轨道理论解释
[编辑]微扰分子轨道
[编辑]同芳香性分子的稳定性可以用分子轨道理论来解释,大部分的描述集中于环䓬离子。Robert C. Haddon尝试用莫比乌斯模型来解释,其中sp3杂化的亚甲基桥碳原子的外层电子反馈给相邻的碳原子,以稳定二者的间距[13]。 Haddon在1975年的研究中称,使用微扰分子轨道理论(PMO)[注 5]可以更好地解释同芳香性。由于添加了一根同共轭键[注 6]干扰了原始阳离子的共振,同䓬离子可以被认为是䓬离子的微扰版本[14]。

一阶效应
[编辑]影响同芳香性的最重要因素是在母体上添加一个同共轭键,由于所有的同芳香性化合物都衍生自具有对称性和键级平均化的芳香化合物,因此同共轭键的插入的位置并不重要。同共轭键的插入对π电子的密度微扰量为δβij,其值取决于环的大小,并且总在0到1之间,其中0代表无微扰,1代表完全丧失芳香性(即开链)[14]。据信,随着环的增大,同芳香性的共振稳定性被形成同共轭键的张力所抵消。同芳香烃的最大环尺寸相当小,一个16元的轮烯环会更倾向于形成芳香性的双阳离子[15]。
二阶效应
[编辑]同共轭键合
[编辑]向同芳香性的分子添加第二个同共轭键会对其微扰分子轨道模型和稳定性产生显著的二阶效应影响。尽管PMO中有一项取决于两个同共轭键的接近程度,但二阶效应通常会带来成倍的不稳定性(相较于添加单个同共轭键)。为了使δβij最小化,从而保持耦合项最小化,双同芳香性物质的形成取决于共振稳定性最大、空间位阻最小的构象。为了使顺-二环[6.1.0]壬-2,4,6-三烯质子化合成1,3-双同环庚三烯阳离子的过程符合理论计算,便在1、3位碳上形成两个亚甲基桥来最大化稳定性[14]。

取代基
[编辑]向同芳香性化合物上添加取代基会对其稳定性造成较大影响,根据取代基与同共轭键的相对位置,取代基可以具有稳定或去稳定作用。以同䓬离子为例,如果在1、3位碳上的取代基为给电子基团,则对同芳香性环有稳定作用。然而,若是在2、4位碳上,则取代基与同共轭键间的相互作用会使同芳香性环变得不稳定。因此甲基或苯基取代的环辛四烯质子化会得到1-取代的产物[14]。

同芳香性化合物
[编辑]下示化合物的同芳香性皆已经通过理论预测和实验证明。
阳离子同芳香性化合物
[编辑]最广为人知的同芳香性物质是阳离子型同芳香性化合物,如前文所述,最经典的同环庚三烯阳离子便是研究最多的同芳香性化合物之一。许多复杂的同芳香性分子都是以环丙烯阳离子、环庚三烯阳离子和环丁二烯阳离子为基础衍生的,而这些物质都是有着显著芳香性的阳离子[16]。
除同䓬离子以外,另一种研究较多的阳离子型同芳香性化合物是降冰片-7-烯基阳离子,其已被实验证明有着特殊的稳定性[17]。

宝塔烷的双阳离子是一个十分有趣的σ-双同芳香性实例,出现了4c-2e,电子在中心平面四边形上离域(其原型的σ-芳香性现象是基于环丙烷的,从该效应中获得了约11.3 kcal/mol的稳定化能)。可以通过氧化宝塔烷或氧化对应的双-断-十二面烷二烯[注 7][18]:
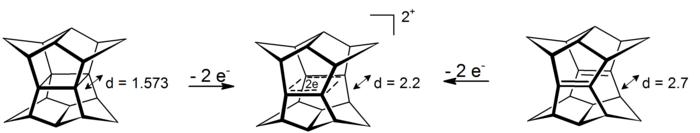
中性同芳香性化合物
[编辑]中性的同芳香性化合物虽能分出许多种,但关于它们的特殊稳定性,究竟是来源于同芳香性,还是其他结构上的原因,仍是有待讨论的。被单个亚甲基桥隔断的中性同芳香性化合物被称作单同芳香烃[注 8],如环庚三烯。也有人认为C60的单亚甲基桥衍生物是具同芳香性的物质,UV和NMR分析表明,这种改性富勒烯的芳香特性不会被同共轭键的加入而破坏[19]。
双同芳香化合物
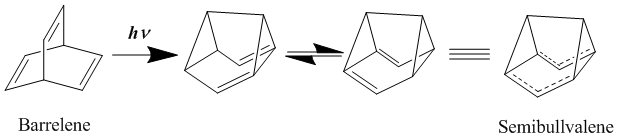
[编辑]中性同芳香性的代表是双同芳香性化合物(bishomoaromatics),如桶烯和半瞬烯。半瞬烯在1966年被合成[20],结构上符合同芳香性理论,不过关于其衍生物是否能以离域、基态的中性同芳香性化合物形式存在仍有许多争论。有研究使用合适取代基衍生化半瞬烯稳定离域过渡态结构,该重排的活化能可以进一步降低,但不能被消除[21][22]。此外,向分子中引入环张力,成环来破坏定域基态稳定结构,是可以得到离域同芳香性基态结构的[23]。
杂原子同芳香性化合物
[编辑]同芳香性不局限于烃类,部分硼、硅[24]化合物也被认为是具同芳香性的中性化合物,如1,2-二硼杂环丁烷和1,2-二硼杂环戊烷。与定域结构式相比,离域结构的1,2-二硼杂环丁烷具有更高的稳定性,表现出显著的同芳香性[25]。当硼原子上的基团为给电子基时,有利于经典的定域分子模型;反之硼与吸电子基相连时,则会表现出明显的同芳香性特征。

三同芳香化合物
[编辑]顾名思义,三同芳香性化合物比双同芳香性化合物多一个额外的面外亚甲基,因此含有三个同共轭键。与半瞬烯相似,三同芳香性化合物的同芳香性特征仍存在诸多争论。理论上它们具有同芳香性,不过复杂的分子内效应使它们的稳定性均不超过苯的5 % [26]。

阴离子同芳香性化合物
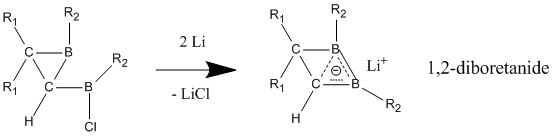
[编辑]与中性同芳香性分子不同,阴离子同芳香性化合物表现出的同芳香性被广泛认可。阴离子型同芳香性化合物可以通过锂还原其母体分子得到,1,2-二硼杂环丁烷阴离子的3c-2e键表现出强烈的同芳香性,与其中性母体相比C-B键更短[27]。此类衍生物可以通过不同的取代基扩展为更大的环,并保有一定程度的同芳香性。
双二氮烯类化合物也表现出不同程度的同芳香性,其双阴离子出现了4c-6e键,实验结果显示N-N间的距离缩短了,证明发生了离域。这一系统内的情况是极其特殊的,电子在四元环σ共轭体系内离域,是首个被证实的4c-6e σ-双同芳香性化合物[28][29]。
同反芳香性
[编辑]近来也有同反芳香性的研究报道,类似于芳香性化合物展现出的稳定性,反芳香性化合物包含4nπ电子的闭环,稳定性较差。二环[3.2.1]辛-3,6-二烯-2-基阳离子中仅含4个π电子,被认为是“双同反芳香烃[注 9]”,计算结果也表明其稳定性比相应的烯丙基阳离子要差[30]。
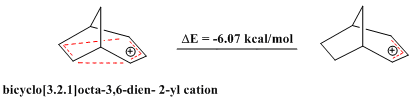
其4-氟苯基衍生物也被证明是反芳香性化合物[30]。

外部链接
[编辑]备注
[编辑]参见
[编辑]参考文献
[编辑]- ^ 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (2006–) "Homoaromatic"。doi:10.1351/goldbook.H02839
- ^ 2.0 2.1 Winstein, S. Homo-Aromatic Structures. J. Am. Chem. Soc. 1959, 81 (24): 6523. doi:10.1021/ja01533a052.
- ^ Freeman, P. K. Neutral Homoaromaticity in Some Neutral Heterocycles. J. Org. Chem. 2005, 70 (6): 1998–2001. PMID 15760178. doi:10.1021/jo040250o.
- ^ Winstein, S.; Sonnenberg, J.; DeVries, L. The Tris-Homocyclopropenyl Cation. J. Am. Chem. Soc. 1959, 81 (24): 6523–6524. doi:10.1021/ja01533a051.
- ^ le Noble, W. J. "Aromaticity" in Highlights of Organic Chemistry: an advanced textbook; Marcel Dekker, Inc.: New York, 1974. ISBN 0-8247-6210-X
- ^ 6.0 6.1 6.2 6.3 Childs, R. F. The Homotropylium Ion and Homoaromaticity. Acc. Chem. Res. 1984, 17 (10): 347–352. doi:10.1021/ar00106a001.
- ^ Hua Yuhui; Zhang Hong; Xia Haiping. History and Development 38 (1): 11–28. 2018. doi:10.6023/cjoc201709009.
- ^ D. P. Craig, A Novel Type of Aromaticity, Nature, 1958, 181: 1052
- ^ Schleyer, P. R. Introduction: Aromaticity. Chem. Rev. 2001, 101 (5): 1115–1118. PMID 11749368. doi:10.1021/cr0103221
 .
.
- ^ 10.0 10.1 Rosenburg, J. L.; Mahler, J. E.; Pettit, R. J. The Bicyclo[5.1.0]octadienyl Cation, A New Stable Carbonium Ion. J. Am. Chem. Soc. 1962, 84 (14): 2842–2843. doi:10.1021/ja00873a051.
- ^ Winstein, S.; Kaesz, H.D.; Kreiter, C.G.; Friedrich, E.C. Homotropylium Ion and its Molybdenum Tricarbonyl Complex. J. Am. Chem. Soc. 1965, 87 (14): 3267–3269. doi:10.1021/ja01092a060.
- ^ Winstein, S.; Kreiter, C.G.; Brauman, J.I. Ring Inversion, Ultraviolet Spectrum, and Electronic Structure of the Monohomotropylium Ion. J. Am. Chem. Soc. 1966, 88 (9): 2047–2048. doi:10.1021/ja00961a037.
- ^ Haddon, R.C. The structure of the homotropenylium cation. Tetrahedron Lett. 1975, 16 (11): 863–866. doi:10.1016/S0040-4039(00)72004-1.
- ^ 14.0 14.1 14.2 14.3 Haddon, R.C. Perturbational molecular orbital (PMO) theory of homoaromaticity. J. Am. Chem. Soc. 1975, 97 (13): 3608–3615. doi:10.1021/ja00846a009.
- ^ Oth, J.F.M.; Smith, D.M.; Prange, U.; Schröder, G. A [16]Annulenediyl Dication. Angew. Chem. Int. Ed. Engl. 1973, 12 (4): 327–328. doi:10.1002/anie.197303271.
- ^ Sal'nikov, G.E.; Genaev, A.M.; Mamatyuk, V.I.; Shubin, V.G. Homophenalenyl cations, new representatives of homoaromatic systems. Russ. J. Org. Chem. 2008, 44 (7): 1000–1005. S2CID 93688550. doi:10.1134/S1070428008070099.
- ^ Carey, F.A.; Sundberg, R.J. Advanced Organic Chemistry: Part A: Structure and Mechanism; Kluwer Academic/Plenum Publishers: New York, 2000; 327-334. ISBN 978-0-387-68346-1
- ^ Prinzbach, H.; Gescheidt, G.; Martin, H.-D.; Herges, R.; Heinze, J.; Prakash, G. K. Surya; Olah, G. A. Cyclic electron delocalization in hydrocarbon cages (pagodanes, isopagodanes, (bisseco-/seco-)-(dodecahedradienes)). Pure and Applied Chemistry: 673–682, 1995. S2CID 96232491. doi:10.1351/pac199567050673.
- ^ Suzuki, T.; Li, Q.; Khemani, K.C.; Wudl, F. Dihydrofulleroid H3C61: synthesis and properties of the parent fulleroid. J. Am. Chem. Soc. 1992, 114 (18): 7301–7302. doi:10.1021/ja00044a055.
- ^ Zimmerman, H. E.; Grunewald, G. L. The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society. 1966, 88: 183–184. doi:10.1021/ja00953a045.
- ^ Dewar, M.J.S.; Lo, D.H. Ground states of .sigma.-bonded molecules. XIV. Application of energy partitioning to the MINDO/2 method and a study of the Cope rearrangement. J. Am. Chem. Soc. 1971, 93 (26): 7201–7207. doi:10.1021/ja00755a014.
- ^ Hoffman, D.; Stohrer, W-D. Cope rearrangement revisited. J. Am. Chem. Soc. 1971, 93 (25): 6941–6948. doi:10.1021/ja00754a042.
- ^ Griffiths, P. R.; Pivonka, D. E.; Williams, R. V. The Experimental Realization of a Neutral Homoaromatic Carbocycle. Chemistry: A European Journal. 2011, 17 (33): 9193–9199. PMID 21735493. doi:10.1002/chem.201100025.
- ^ Keuter J; Hepp A; Massolle A; Neugebauer J; Mück-Lichtenfeld C; Lips F. Synthesis and Reactivity of a Neutral Homocyclic Silylene. Angew Chem Int Ed Engl. 2022, 61 (5). PMID 34797603. doi:10.1002/anie.202114485.
- ^ Steiner, D.; Balzereit, C.; Winkler, H. J. R.; Stamatis, N.; Massa, W.; Berndt, A.; Hofmann, M.; Von Ragué Schleyer, P. Nonclassical 1,2-Diboretanes and 1,2-Diborolanes. Angewandte Chemie International Edition in English. 1994, 33 (22): 2303–2306. doi:10.1002/anie.199423031.
- ^ Martin, H.D.; Mayer, B. Proximity Effects in Organic Chemistry?The Photoelectron Spectroscopic Investigation of Non-Bonding and Transannular Interactions. Angew. Chem. Int. Ed. Engl. 1983, 22 (4): 283–314. doi:10.1002/anie.198302831.
- ^ Steiner, D.; Winkler, H.; Balzereit, C.; Happel, T.; Hofmann, M.; Subramanian, G.; Schleyer, P.V.R.; Massa, W.; Berndt, A. 1,2-Diboretanides: Homoaromatic 2π-Electron Compounds with High Inversion Barriers. Angew. Chem. Int. Ed. Engl. 1996, 35 (17): 1990–1992. doi:10.1002/anie.199619901.
- ^ Exner, K.; Hunkler, D.; Gescheidt, G.; Prinzbach, H. Do Nonclassical, Cyclically Delocalized 4N/5e Radical Anions and 4N/6e Dianions Exist? – One- and Two-Electron Reduction of Proximate, Synperiplanar Bis-Diazenes. Angew. Chem. Int. Ed. Engl. 1998, 37 (13–14): 1910–1913. doi:10.1002/(SICI)1521-3773(19980803)37:13/14<1910::AID-ANIE1910>3.0.CO;2-D.
- ^ Exner, K.; Cullmann, O.; Vögtle, M.; Prinzbach, H.; Grossmann, B.; Heinze, J.; Liesum, L.; Bachmann, R.; Schweiger, A.; Gescheidt, G. Cyclic In-Plane Electron Delocalization (σ-Bishomoaromaticity) in 4N/5e Radical Anions and 4N/6e Dianions – Generation, Structures, Properties, Ion-Pairing, and Calculations. J. Am. Chem. Soc. 2000, 122 (43): 10650–10660. doi:10.1021/ja0014943.
- ^ 30.0 30.1 Volz, H.; Shin, J. Bicyclo[3.2.1]octa-3,6-dien-2-yl Cation: A Bishomoantiaromate. J. Org. Chem. 2006, 71 (6): 2220–2226. PMID 16526766. doi:10.1021/jo0515125.



