脂类
此条目需要精通或熟悉相关主题的编者参与及协助编辑。 (2013年8月23日) |

脂质可以广义定义为疏水性或双亲性小分子;某些脂质因为其双亲性的特质(兼具亲水性与疏水性),能在水溶液环境中形成囊泡、脂质体或膜等构造。生物体内的脂质完全或部分源自两种截然不同的生物次单元:酮酸基与异戊二烯[7]。由此,脂质可以概分为八类:脂肪酸、甘油酯、甘油磷脂、鞘脂(神经脂质)、糖脂质、聚酮类(由酮乙基次单元聚合而成)、固醇脂类,以及孕烯醇酮脂类(由异戊二烯次单元缩合聚合而成)[5][8]。
脂类包含脂肪,而非其同义词;脂肪只是一种称为三酸甘油酯的脂类。脂类也包括脂肪酸及其衍生物,包括单酸甘油酯、二酸甘油酯、磷脂等,也包括其他含有固醇的代谢产物,像是胆固醇[9]。虽然人类和其他动物有许多不同的代谢方式,可以切断脂肪链及合成脂质,不过仍有一些必需脂质无法自行合成,需要在食物中摄取。
脂质形成原始生命体的细胞膜是生命起源模型中的关键步骤[10]。
分类
[编辑]| 1.脂肪酰类,Fatty Acyls, FA |
|---|
| 脂肪酸,Fatty acid,FA |
| (O-酰基)-1-羟基脂肪酸,(O-acyl)-1-hydroxy fatty acid,OAHFA |
| 2.甘油酯类,Glycerolipids, GL |
|---|
| 甘油一酯,Monoglyceride,MG |
| 甘油二酯,Diglyceride,DG |
| 甘油三酯,Triglyceride,TG |
| 氘代甘油二酯,Deuterated diglyceride,D5DG |
| 氘代甘油三酯,Deuterated triglyceride,D5TG |
| 3.甘油磷脂类,Glycerophospholipids,GP |
|---|
| 溶血磷脂酰胆碱,Lyso-phosphatidylcholine,LPC |
| 溶血磷脂酰乙醇胺,Lyso-phosphatidylethanolamine,LPE |
| 溶血磷脂酰肌醇,Lyso-phosphatidylinositol,LPI |
| 溶血磷脂酰甘油,Lyso-phosphatidylglycerol,LPG |
| 溶血磷脂酰丝氨酸,Lyso-phosphatidylserine,LPS |
| 溶血磷脂酸,Lyso-phosphatidic acid,LPA |
| 溶血磷脂酰乙醇,Lyso-phosphatidylethanol,LPEt |
| 溶血磷脂酰乙醇,Lyso-phosphatidylmethanol,LPMe |
| 溶血二甲基磷脂酰乙醇胺,Lysodimethylphosphatidylethanolamine,LdMePE |
| 磷脂酰胆碱,Phosphatidylcholine,PC |
| 磷脂酰乙醇胺,Phosphatidylethanolamine,PE |
| 磷脂酰肌醇,Phosphatidylinositol,PI, PIP, PIP2, PIP3 |
| 磷脂酰甘油,Phosphatidylglycerol,PG |
| 磷脂酰丝氨酸,Phosphatidylserine,PS |
| 磷脂酸,Phosphatidic acid,PA |
| 血小板活化因子,Platelet-activating factor,PAF |
| 磷脂酰乙醇,Phosphatidylethanol,PEt |
| 磷脂酰甲醇,Phosphatidylmethanol,PMe |
| 环磷脂酸,Cyclic phosphatidic acid,cPA |
| 二甲基磷脂酰乙醇胺,Dimethylphosphatidylethanolamine,dMePE |
| 心磷脂,Cardiolipin,CL |
| 4.鞘脂类,Sphingolipids, SP |
|---|
| 鞘磷脂,Sphingomyelin,SM |
| 溶血鞘磷脂,Lysosphingomyelin,LSM |
| 鞘磷脂(植物鞘氨醇),Sphingomyelin(phytosphingosine),phSM |
| 鞘氨醇,Sphingoshine,So |
| 磷酸鞘氨醇,Sphingoshine phosphate,SoP |
| 神经酰胺,Ceramides,Cer |
| 磷酸神经酰胺,Ceramides phosphate,CerP |
| 神经节苷脂,Gangliosides,GM1, GM2, GM3, GD1a, GD1b, GD2, GD3, GT1a, GT1b, GT1c, GT2, GT3, GQ1b, GQ1c |
| 5.固醇脂类,Sterol Lipids, ST |
|---|
| 胆固醇酯,Cholesteryl Ester,ChE |
| 胆固醇酯,Cholesterylesters,CE |
| 酵母甾醇,Zymosteryl,ZyE |
| 豆甾醇酯,Stigmasteryl ester,StE |
| 谷甾醇酯,Sitosteryl ester,SiE |
| 氘代胆固醇酯,Deuterated Cholesteryl Ester,D7ChE |
| 6.孕烯醇酮脂类,Prenol Lipids, PR |
|---|
| 辅酶,Coenzyme,Co |
| 7.糖脂类,葡萄糖鞘氨醇,Glucosylsphingoshine,SoG1 |
|---|
| (Saccharolipids, SL),单糖基神经酰胺,Monogylcosylceramide,CerG1 |
| 双糖基神经酰胺,Diglycosylceramide,CerG2 |
| 三糖基神经酰胺,Triglycosyl-ceramide,CerG3 |
| 糖基神经酰胺系列,Simple Glc series,CerG2GNAc1, CerG2GNAc2, CerG2GNAc3 |
| 单半乳糖单酰甘油酯,Monogalactosylmonoacylglycerol,MGMG |
| 单半乳糖二酰甘油酯,Monogalactosyldiacylglycerol,MGDG |
| 双半乳糖基单酰甘油酯,Digalactosylmonoacylglycerol,DGMG |
| 双半乳糖基二酰甘油酯,Digalactosyldiacylglycerol,DGDG |
| 硫代异鼠李糖甘油一酯,Sulfoquinovosylmonoacylglycerol,SQMG |
| 硫代异鼠李糖甘油二酯,Sulfoquinovosyldiacylglycerol,SQDG |
| 8.聚酮类,Polyketides,PK |
|---|
| 抗生素,Antibiotic,ABX |
| 真菌霉素,Mycotoxins,MT |
| 天然色素,NaturalPigments,NP |
脂肪酸类
[编辑]

脂123酸,或是脂质中的脂肪酸残留部分,是由乙酰辅酶A和丙二酰辅酶A及甲基丙二酸单酰辅酶A合成的许多不同种类的分子,合成的反应称为脂肪酸合成[12][13]。脂肪酸是由尾端为羧酸官能基的碳链组成,因此分子会有有极性且亲水的一端,另一端则是非极性且疏水的。脂肪酸结构是生物脂质中最基本的结构,常用来建构更复杂脂质[14]。碳链长度一般介于4到24个碳之间[15],可能是饱和化合物或是不饱和化合物,也可能连结其他含有氧、卤素、氮或是硫的官能基。若脂肪酸中含有双键,则可能会有顺式及反式的顺反异构,对分子组态有很大的影响。顺式的双键会使碳链弯曲,若是分子中有多个双键,反应会更明显。18个碳的亚麻酸中有三个双键,是植物的类囊体膜中最丰富的脂肪酸酰基链,因此在环境低温时,仍可以使囊膜有高度的流动性[16]。大部分天然的(有双键的)脂肪酸是顺式的,不过有些天然的脂肪酸是反式的,而人工氢化的脂肪和油类也是反式的[17]。
在生物中重要的脂肪酸包括主要衍生自花生四烯酸的类花生酸,另一种为二十碳五烯酸(EPA),包括前列腺素、白三烯、血栓素等。二十二碳六烯酸(DHA)对生物体也相当的重要,尤其是在生物的视觉上[18][19]。其他重要的脂肪酸类脂质包括脂肪酸酯及脂肪酸胺,脂肪酸酯包括重要的生物化学中间产物,例如蜡酯、及脂肪酸硫酯辅酶A衍生物、脂肪酸硫酯酰基载体蛋白衍生物、及脂肪酸肉碱。脂肪酸胺包括N-脂肪酰基胺,例如大麻素中的神经传导物质花生四烯酸乙醇胺[20]。
甘油酯类
[编辑]
甘油酯中包括单酸、二酸及三酸甘油酯[21],分别是甘油和一、二、三个脂肪酸形成的酯类,其中最为人知的是三酸甘油酯,其中甘油 的三个羟基和脂肪酸反应,多半会是三种不同的脂肪酸。动物会用脂质储存能量,而这些脂质也会储存在动物的脂肪组织中。在代谢脂肪时三酸甘油酯的酯键会断裂,分解为甘油和脂肪酸[22]。
甘油酯类中的化合物还包括甘油葡糖苷(glycosylglycerol),是甘油和单糖由糖苷键键结的化合物,例如在植物薄膜中常见的二半乳糖基二脂酰甘油(digalactosyldiacylglycerol)[23],或是哺乳类精子中常见的精脂[24]。
甘油磷脂类
[编辑]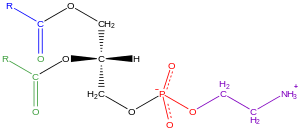
甘油磷脂一般简称为磷脂,是含有磷酸的脂类,出现在自然界及细胞的磷脂双分子层中[25],和新陈代谢和细胞信号传送有关[26]。神经组织(包括大脑)含有大量的磷脂,其成分的改变意味着有可能有神经的病变[27]。磷脂可以分为两类,真核生物及细菌中的磷脂,其极性的分子团连结在甘油的sn-3位上,而古菌中的磷脂,其极性的分子团连结在甘油的sn-1位上[28]。
生物膜中常见的磷脂有磷脂酰胆碱(也称为PC、GPCho或卵磷脂)、磷脂酰乙醇胺(PE或GPEtn)及磷脂丝胺酸(也称为PS或GPSer)。磷脂除了作为细胞膜的主要成分,以及结合细胞内或细胞间蛋白质外。有些真核生物细胞中的磷脂是细胞膜衍生的第二信使系统或是其前驱体,这类磷脂有磷脂酰肌醇及磷脂酸[29]。一般而言甘油的一或两个羟基会连接长链的脂肪酸,不过也有连接烷基或是1Z-烯基(缩醛磷脂的磷脂,例如古菌中的二烷基醚变体[30]。
鞘脂类
[编辑]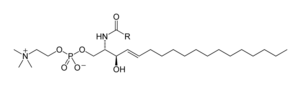
鞘脂是一组复杂化合物的统称[31],有共同的鞘氨醇碱(sphingoid base)骨架,是由丝胺酸和长脂肪链的酰基辅酶A从头合成,之后转换为神经酰胺、磷鞘脂、糖鞘脂和其它化合物。哺乳动物的鞘氨醇碱一般是指鞘氨醇。神经酰胺是常见的鞘氨醇碱衍生物,有一个连接酰胺基的脂肪酸。其脂肪酸多半是饱和脂肪酸或是单元不饱和脂肪酸,碳链长度约为16至26个碳原子[32]
哺乳类体内的鞘脂主要以鞘磷脂为主[33].而昆虫体内则主要是磷酸乙醇胺神经酰胺[34],真菌体内有植物神经磷酸肌醇及含有甘露糖的鞘脂[35]。糖鞘脂是鞘脂和糖以糖苷键连结的化合物,例如构造简单的脑苷脂以及较复杂的神经节苷脂。
固醇类
[编辑]固醇包括胆固醇及其衍生物,和甘油磷脂、鞘磷脂同为组成生物膜的重要成分[36]。固醇都有相同的四环结构,是身体中的激素及细胞信号传送,有着不同的角色。18个碳的固醇包括雌激素,C19的固醇包括雄激素,例如睾酮及雄甾酮。C21的固醇包括孕激素、糖皮质激素及盐皮质激素[37]。开环类固醇包括许多不同形式的维生素D,其特征是固醇主结构中B环的开环[38]其他的固醇有胆汁酸及其共轭碱[39],是哺乳类氧化胆固醇后的衍生物,在肝脏中生成。植物中的固醇称为植物固醇,例如β-谷固醇、豆固醇及菜籽固醇,后者也是判断藻类生长的生物标记[40]。真菌细胞膜中主要的固醇为麦角固醇[41]。
异戊烯醇脂类
[编辑]异戊烯醇酯是由五碳异戊烯基二磷酸及二甲基烯丙基二磷酸合成,主要是透过甲羟戊酸路径[42]。简单的类异戊二烯是由C5单元的连续加成所形成,依照萜烯的数量来分类。超过40个碳的萜称为多萜。类胡萝卜素是重要的简单类异戊二烯,是抗氧化剂,也是维生素A的前驱体[43]。另一种重要的分子是醌及对苯二酚[44]。维生素E、维生素K及辅酶Q10也属于这一类。原核生物会合成聚异戊二烯醇(细菌萜醇),连接在氧原子上的终端异戊二烯是未饱和的,而动物产生的聚异戊二烯醇(多萜醇)其终端异戊二烯已被还原[45]。
糖脂类
[编辑]
糖脂是指脂肪酸直接连结到糖的骨架,产生和双层脂膜相容的结构。由单糖取代了甘油酯和磷脂中甘油的骨架角色。最常见的糖脂是脂质A的前体,是革兰氏阴性菌中脂多糖之成分之一。典型的脂质A分子有葡萄糖胺双糖,是加了七个脂肪酸链的衍生物。大肠杆菌生长需要的最小多糖脂为Kdo2-Lipid A,是葡萄糖胺的六酰化二糖,其中有二个糖基化的3-脱氧-D-甘露-2-辛酮糖(Kdo)残基[46]。
聚酮类
[编辑]聚酮是由乙酰基及丙酰辅酶A的子单位组成,借由经典的酶聚合的产物。其中包括大量动物、植物、细菌、真菌及海洋生物的次级代谢产物及天然产物,在结构上有很大的不同[47][48]。 许多聚酮是有环的分子,其主结构经糖基化、甲基化、羟基化、氧化或是其他化学反应。许多常用的抗菌药、抗寄生物药及抗癌药物是聚酮或其衍生物,例如红霉素、四环素类抗生素、阿佛菌素及抗肿瘤的埃皮霉素[49]。
生物功能
[编辑]生物膜
[编辑]真核细胞用生物膜分隔成数个细胞器,各自有不同的生物机能。甘油磷脂是生物膜的主要成分,像细胞膜和细胞器的细胞内Intracellular,动物细胞是由细胞膜分隔细胞内和细胞外的环境。甘油磷脂是两亲分子,分子中同时具有亲水性及亲脂性的基团,其中以甘油为中心,借由酯键连结到二个脂肪基的亲脂性“尾巴”,另外一个酯键连结到一个磷酸的亲水性“头”。生物膜主要是以甘油磷脂为主,但也有一些没有甘油的脂类,像鞘磷脂、胆固醇[50]。在植物及藻类中,缺少磷酸基的磺酸基异鼠李糖基二脂酰基甘油(sulfoquinovosyldiacylglycerol)是叶绿体以其他有关细胞器膜的主要成分,也是高等植物、藻类及一些细菌的光合组织中最丰富的脂类。
植物的类囊体膜含有形成非双层膜的单半乳糖甘油二酯(MGDG),且是其中比例最多的脂质,其中也有少量的磷脂。而叶绿体类囊体膜中用磁共振及电子显微镜也发现有动态的脂质双层膜基质[51]。
双层膜发现有高度的双折射,可以用双偏振极化干涉测量及圆二色性来量测双层膜的规则性或变型程度。

生物膜是种层状相的磷脂双分子层,若磷脂是在水溶液的环境中,磷脂双分子层的形成是能量考量偏好的过程[52]。这称为疏水效应。在水溶液中,磷脂极性的头朝向极性的水分子,而疏水的尾巴减少对水的接触,彼此距离更加紧密,形成囊泡。依脂质浓度的不同,会生成脂质体、胶束(micelle)及脂质双分子层。也观察到有其他聚合的形式,都是两亲分子的脂质多态性的一部分,这是生物物理学学术研究的主题之一[53][54]。在极性介质中生成脂质体及胶束的过程称为疏水效应[55]。当在极性环境中溶解两亲性或是亲脂性的物质,因此这些分子的极性分子(例如水溶液中的水)会更加有序。所以在水溶液的环境中,在亲脂性分子附近会有有序的晶笼结构[56]。
能量储存
[编辑]动植物体内的三酸甘油酯储存在脂肪组织内,是动植物的主要能量来源之一。脂肪细胞设计为可连续生成或分解三酸甘油酯,而其分解主要是透过由荷尔蒙驱动的脂酶来启动[57]。脂肪酸的完整氧化可以产生高热量,约为9 kcal/g,而糖和蛋白质氧化只能产生4 kcal/g的热量,鸟类之所以可以在不进食的条件下长期间飞行,就是利用体内三酸甘油酯储存的热量[58]。
信号传送
[编辑]最近几年的研究发现脂质信号传送是细胞信号传送中基本的一部分[59][60]。脂质信号传送可以由G蛋白偶联受体或是核受体启动,而且已发现许多不同种类的脂质是信号分子或是第二信使系统的一部分[61]。这类脂质包括1-磷酸鞘氨醇,由神经酰胺衍生的鞘脂,是钙调节[62]、细胞生长及凋亡有关的信息分子[63],二酸甘油酯(DAG)及磷酸磷脂酰肌醇(PIPs)和蛋白激酶C以钙来引导的活化有关[64],前列腺素是一种脂肪酸衍生的类二十烷酸,和炎症和免疫有关[65],甾体荷尔蒙包括雌激素、睾酮及皮质醇,调节像生殖、代谢及血压等机能,像25-羟基胆固醇等氧化胆固醇是肝X受体的激动剂[66]。
其他功能
[编辑]脂溶性维生素(如维生素A、D、E、K)是萜烯的脂质,是人体必需的营养素,储存在肝脏及脂肪组织中,有许多不同的功能。肉碱和脂肪酸的运输及代谢时,进出线粒体有关,其中会进行β-氧化[67]。在运输寡糖进出细胞膜的过程中,聚异戊二烯和其磷酸化的衍生物也起到重要的作用的。聚异戊二烯醇的磷酸糖及二磷酸糖在细胞质外的糖基化反应、细胞外的生物多糖合成(例如细菌进行的肽聚糖聚合)及真核蛋白质的N-糖基化中都有其作用[68][69]。心磷脂是一种含有四个酰基及三个甘油基团的甘油酰磷脂,在线粒体内膜中相当丰富[70][71][72]。一般认为他们可以活化和氧化磷酸化有关的酶[73]。脂质也是形成甾体荷尔蒙的原料[74]。
代谢体学
[编辑]人类和其他动物食物常见的脂质有动物及植物的三酸甘油酯、固醇,和生物膜的磷脂。脂质代谢的过程可以合成及降解储存的脂质,并产生个别组织需要的结构性及机能性的脂质。
生物合成
[编辑]动物若摄取了过量的糖类,过量的糖类会转换为三酸甘油酯,过程中包括由乙酰辅酶A合成脂肪酸,以及将脂肪酸酯化形成三酸甘油酯,后者称为脂肪生成[75]。脂肪酸合酶合成脂肪酸的过程是先聚合,再还原乙酰辅酶A单元。脂肪酸中的酰链是在一连串的反应中延长,一开始先加入乙酰基,还原后得到醇类,脱水得到烯类,再还原后得到烷类。生物合成脂肪酸的酶分为二类,在动物及真菌中,脂肪酸的合成反应是由单一的多功能蛋白质实现[76],而在植物色素体及细菌体内是由不同的酶分工进行[77][78]。脂肪酸会转换为三酸甘油酯,包裹在脂蛋白中,并在肝脏中释出。
不饱和脂肪酸的生成需要脂肪酸去饱和反应,在脂肪酰基中引入双键酸。在人体身内,硬脂酸透过固醇辅酶A去饱和酶1会变成油酸,是单元不饱和脂肪酸。但人体组织无法生成有二个双键的亚油酸及三个双键的Α-亚麻酸,因此这些多元不饱和脂肪酸需在饮食中摄取,称为必需脂肪酸[79]。
三酸甘油酯的生成是在内质网中进行,其中在乙酰辅酶A中的酰基转换为甘油-3-磷酸及二酸甘油酯中的羟基[80]。
萜烯和类萜(如类胡萝卜素)的生成是由异戊二烯单元的组合和修饰,异戊二烯单元是由活性的前驱体焦磷酸异戊烷及焦磷酸二甲基烯丙酯提供[81]。前驱体的生成方式有许多种:在动物及古菌中会透过甲羟戊酸途径,由乙酰辅酶A产生这些化合物[82],而在植物和细菌中非甲羟戊酸途径用丙酮酸及甘油醛3-磷酸来产生[81][83]。会用到这些化合物的一种重要反应为甾体生成反应,其中会结合异戊二烯单元,生成鲨烯,再折叠产生甾体环,生成羊毛固醇[84]。羊毛固醇可以生成像胆固醇及麦角固醇等固醇[84][85]。
降解
[编辑]脂肪酸的代谢是透过在线粒体或/及过氧化体中进行的β-氧化反应,产生乙酰辅酶A。大部分的情形中,脂肪酸氧化的机制类似脂肪酸合成的逆反应。在脱氢、水合及氧化反应后,脂肪酸会脱落二个碳,借由硫解产生酮酸。乙酰辅酶A最后会由三羧酸循环及电子传递链,转换为三磷酸腺苷(ATP)、CO2及H2O。
若体内没有葡萄糖或是含量不多时,三羧酸循环可以由乙酰辅酶A开始,并且分解脂肪以产生能量。
脂肪酸棕榈酸酯在完全氧化后,可产生对应106个ATP的能量[86]。不饱和脂肪酸及奇数链长的脂肪酸需要额外的酶反应才能降解。
营养和健康
[编辑]大部分食物中的脂质是三酸甘油酯、甾醇和磷脂。若食物中有一些脂质,有助于脂溶性的维生素(如维生素A、D、E、K)及类胡萝卜素的吸收[87]。人类和其他哺乳类因为无法合成一些特定的脂肪酸,需要借由食物摄取,称为必需脂肪酸,例如ω-6脂肪酸的亚油酸及ω-3脂肪酸的α-亚麻酸[79] 。上述两种脂肪酸都是18个碳的多元不饱和脂肪酸,但双键的数量和位置有所不同。大部分的植物油含有大量的亚油酸,像是红花油、葵花籽油及玉米油等。α-亚麻酸则主要是在植物的叶子及以一些特定的种子、核果及豆类中,例如亚麻、油菜籽、核桃及大豆[88]。鱼油中有大量长链的ω-3脂肪酸,例如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。[89]许多研究显示摄取ω-3脂肪酸对于婴儿发展、癌症及心血管疾病的预防,以及像抑郁症,注意力缺陷多动障碍和痴呆等精神疾病的预防都有帮助[90][91]。相反的,摄取由植物油部分氢化产生的反式脂肪是可能造成心血管疾病的危险因子[92][93][94]。
许多研究指出每日脂肪的摄取量和肥胖症[95][96]及糖尿病[97][98]的风险有正相关。不过也有许多研究指出脂肪的摄取量和这些疾病没有相关性,这些研究包括女性健康行动针对约五万名妇女为期八年的饮食调整试验、护士健康研究以及卫生专业人员的随访研究等[99][100][101]。这些研究认为热量中来自脂肪的比例和癌症、心脏疾病和体重的增加没有关系。哈佛公共卫生学院营养系的网站Nutrition Source总结了饮食中总脂肪量对人体的影响:“详细的研究(其中大部分是在哈佛进行)指出,饮食中总脂肪量和体重的变化或是疾病没有关系。”[102]。
相关条目
[编辑]参考文献
[编辑]- ^ Maitland, Jr Jones. Organic Chemistry. W W Norton & Co Inc (Np). 1998: 139. ISBN 0-393-97378-6.
- ^ Stryer et al., p. 328.
- ^ Stryer et al., p. 330.
- ^ 生物1 必修 分子与细胞. 人民教育出版社. 2007: 32–33. ISBN 978-7-107-17670-8.
- ^ 5.0 5.1 Fahy E, Subramaniam S, Murphy R, Nishijima M, Raetz C, Shimizu T, Spener F, Van Meer G, Wakelam M and Dennis E.A. Update of the LIPID MAPS comprehensive classification system for lipids. Journal of Lipid Research. 2009, 50 (Supplement): S9–S14. PMC 2674711
 . PMID 19098281. doi:10.1194/jlr.R800095-JLR200.
. PMID 19098281. doi:10.1194/jlr.R800095-JLR200.
- ^ Subramaniam S, Fahy E, Gupta S, Sud M, Byrnes RW, Cotter D, Dinasarapu AR, Maurya MR. Bioinformatics and systems biology of the lipidome. Chemical Reviews. October 2011, 111 (10): 6452–6490. PMC 3383319
 . PMID 21939287. doi:10.1021/cr200295k.
. PMID 21939287. doi:10.1021/cr200295k.
- ^ Fahy E, Subramaniam S, Brown HA; et al. A comprehensive classification system for lipids. Journal of Lipid Research. 2005, 46 (5): 839–61. PMID 15722563. doi:10.1194/jlr.E400004-JLR200.
- ^ 蔡潭溪、刘平生、杨福全、杨福愉. 脂质组学研究进展 (PDF). 生物化学与生物物理进展. 2010, 37 (2): 121–128 [2013-04-11]. (原始内容存档 (PDF)于2016-03-05).
- ^ Michelle A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD. Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. 1993. ISBN 0-13-981176-1. OCLC 32308337.
- ^ Segré D, Ben-Eli D, Deamer DW, Lancet D. The lipid world (PDF). Origins of Life and Evolution of the Biosphere. 2001, 31 (1–2): 119–45 [2022-02-13]. Bibcode:2001OLEB...31..119S. PMID 11296516. S2CID 10959497. doi:10.1023/A:1006746807104. (原始内容 (PDF)存档于2008-09-11).
- ^ Mashaghi S., Jadidi T., Koenderink G., Mashaghi A. Lipid Nanotechnology. Int. J. Mol. Sci. 2013, 2013 (14): 4242–4282 [2013-04-11]. doi:10.3390/ijms14024242. (原始内容存档于2019-09-03).
- ^ Vance JE, Vance DE. Biochemistry of Lipids, Lipoproteins and Membranes. Amsterdam: Elsevier. 2002. ISBN 0-444-51139-3. OCLC 51001207.
- ^ Brown HA (编). Lipodomics and Bioactive Lipids: Mass Spectrometry Based Lipid Analysis, Volume 432 (Methods in Enzymology). Boston: Academic Press. 2007. ISBN 0-12-373895-4. OCLC 166624879.
- ^ Mandal, Ananya. Types of Lipids. news-medical.net. [2014-07-08]. (原始内容存档于2016-01-10).
- ^ Hunt SM, Groff JL, Gropper SAS. Advanced Nutrition and Human Metabolism. Belmont, CA: West Pub. Co. 1995: 98. ISBN 0-314-04467-1.
- ^ YashRoy R.C. (1987) 13-C NMR studies of lipid fatty acyl chains of chloroplast membranes. Indian Journal of Biochemistry and Biophysics, vol. 24(6), pp. 177-178.https://www.researchgate.net/publication/230822408_13-C_NMR_studies_of_lipid_fatty_acyl_chains_of_chloroplast_membranes?ev=prf_pub (页面存档备份,存于互联网档案馆)
- ^ Hunter JE. Dietary trans fatty acids: review of recent human studies and food industry responses. Lipids. November 2006, 41 (11): 967–92. PMID 17263298. doi:10.1007/s11745-006-5049-y.
- ^ A Long Lipid, a Long Name: Docosahexaenoic Acid. The Lipid Chronicles. [2011-12-31]. (原始内容存档于2016-03-28).
- ^ DHA FOR OPTIMAL BRAIN AND VISUAL FUNCTIONING. DHA/EPA Omega-3 Institute. [2014-07-08]. (原始内容存档于2016-03-10).
- ^ Fezza F, De Simone C, Amadio D, Maccarrone M. Fatty acid amide hydrolase: a gate-keeper of the endocannabinoid system. Subcellular Biochemistry. Subcellular Biochemistry. 2008, 49: 101–32. ISBN 978-1-4020-8830-8. PMID 18751909. doi:10.1007/978-1-4020-8831-5_4.
- ^ Coleman RA, Lee DP. Enzymes of triglyceride synthesis and their regulation. Progress in Lipid Research. 2004, 43 (2): 134–76. PMID 14654091. doi:10.1016/S0163-7827(03)00051-1.
- ^ van Holde and Mathews, p. 630–31.
- ^ Hölzl G, Dörmann P. Structure and function of glycoglycerolipids in plants and bacteria. Progress in Lipid Research. 2007, 46 (5): 225–43. PMID 17599463. doi:10.1016/j.plipres.2007.05.001.
- ^ Honke K, Zhang Y, Cheng X, Kotani N, Taniguchi N. Biological roles of sulfoglycolipids and pathophysiology of their deficiency. Glycoconjugates Journal. 2004, 21 (1–2): 59–62. PMID 15467400. doi:10.1023/B:GLYC.0000043749.06556.3d.
- ^ The Structure of a Membrane. The Lipid Chronicles. [2011-12-31]. (原始内容存档于2016-06-10).
- ^ Berridge MJ, Irvine RF. Inositol phosphates and cell signalling. Nature Journal. 1989, 341 (1): 197–205. doi:10.1038/341197a0.
- ^ Farooqui AA, Horrocks LA, Farooqui T. Glycerophospholipids in brain: their metabolism, incorporation into membranes, functions, and involvement in neurological disorders. Chemistry and Physics of Lipids. 2000, 106 (1): 1–29. PMID 10878232. doi:10.1016/S0009-3084(00)00128-6.
- ^ Ivanova PT, Milne SB, Byrne MO, Xiang Y, Brown HA. Glycerophospholipid identification and quantitation by electrospray ionization mass spectrometry. Methods in Enzymology. Methods in Enzymology. 2007, 432: 21–57. ISBN 9780123738950. PMID 17954212. doi:10.1016/S0076-6879(07)32002-8.
- ^ van Holde and Mathews, p. 844.
- ^ Paltauf F. Ether lipids in biomembranes. Chemistry and Physics of Lipids. 1994, 74 (2): 101–39. PMID 7859340. doi:10.1016/0009-3084(94)90054-X.
- ^ Merrill AH, Sandhoff K. (2002). "Sphingolipids: metabolism and cell signaling" (页面存档备份,存于互联网档案馆), Ch. 14 in New Comprehensive Biochemistry: Biochemistry of Lipids, Lipoproteins, and Membranes, Vance, D.E. and Vance, J.E., eds. Elsevier Science, NY, ISBN 978-0-12-182212-5.
- ^ Devlin, pp. 421–22.
- ^ Hori T, Sugita M. Sphingolipids in lower animals. Prog. Lipid Res. 1993, 32 (1): 25–45. PMID 8415797. doi:10.1016/0163-7827(93)90003-F.
- ^ Wiegandt H. Insect glycolipids. Biochimica et Biophysica Acta. 1992, 1123 (2): 117–26. PMID 1739742. doi:10.1016/0005-2760(92)90101-Z.
- ^ Guan X, Wenk MR. Biochemistry of inositol lipids. Frontiers in Bioscience. 2008, 13 (13): 3239–51. PMID 18508430. doi:10.2741/2923.
- ^ Bach D, Wachtel E. Phospholipid/cholesterol model membranes: formation of cholesterol crystallites. Biochim Biophys Acta. 2003, 1610 (2): 187–97. PMID 12648773. doi:10.1016/S0005-2736(03)00017-8.
- ^ Stryer et al., p. 749.
- ^ Bouillon R, Verstuyf A, Mathieu C, Van Cromphaut S, Masuyama R, Dehaes P, Carmeliet G. Vitamin D resistance. Best Practice & Research. Clinical Endocrinology & Metabolism. 2006, 20 (4): 627–45. PMID 17161336. doi:10.1016/j.beem.2006.09.008.
- ^ Russell DW. The enzymes, regulation, and genetics of bile acid synthesis. Annual Review of Biochemistry. 2003, 72: 137–74. PMID 12543708. doi:10.1146/annurev.biochem.72.121801.161712.
- ^ Villinski JC, Hayes JM, Brassell SC, Riggert VL, Dunbar RB. Sedimentary sterols as biogeochemical indicators in the Southern Ocean. Organic Geochemistry. 2008, 39 (5): 567–88. doi:10.1016/j.orggeochem.2008.01.009.
- ^ Deacon J. Fungal Biology. Cambridge, MA: Blackwell Publishers. 2005: 342. ISBN 1-4051-3066-0.
- ^ Kuzuyama T, Seto H. Diversity of the biosynthesis of the isoprene units. Natural Product Reports. 2003, 20 (2): 171–83. PMID 12735695. doi:10.1039/b109860h.
- ^ Rao AV, Rao LG. Carotenoids and human health. Pharmacological Research : the Official Journal of the Italian Pharmacological Society. 2007, 55 (3): 207–16. PMID 17349800. doi:10.1016/j.phrs.2007.01.012.
- ^ Brunmark A, Cadenas E. Redox and addition chemistry of quinoid compounds and its biological implications. Free Radical Biology & Medicine. 1989, 7 (4): 435–77. PMID 2691341. doi:10.1016/0891-5849(89)90126-3.
- ^ Swiezewska E, Danikiewicz W. Polyisoprenoids: structure, biosynthesis and function. Progress in Lipid Research. 2005, 44 (4): 235–58. PMID 16019076. doi:10.1016/j.plipres.2005.05.002.
- ^ 46.0 46.1 Raetz CR, Garrett TA, Reynolds CM, Shaw WA, Moore JD, Smith DC Jr, Ribeiro AA, Murphy RC,Ulevitch RJ, Fearns C, Reichart D, Glass CK, Benner C, Subramaniam S, Harkewicz R, Bowers-Gentry RC, Buczynski MW, Cooper JA, Deems RA, Dennis EA. Kdo2-Lipid A of Escherichia coli, a defined endotoxin that activates macrophages via TLR-4. Journal of Lipid Research. 2006, 47 (5): 1097–111. PMID 16479018. doi:10.1194/jlr.M600027-JLR200.
- ^ Walsh CT. Polyketide and nonribosomal peptide antibiotics: modularity and versatility. Science. 2004, 303 (5665): 1805–10. PMID 15031493. doi:10.1126/science.1094318.
- ^ Caffrey P, Aparicio JF, Malpartida F, Zotchev SB. Biosynthetic engineering of polyene macrolides towards generation of improved antifungal and antiparasitic agents. Current Topics in Medicinal Chemistry. 2008, 8 (8): 639–53 [2009-04-12]. PMID 18473889. doi:10.2174/156802608784221479.[永久失效链接]
- ^ Minto RE, Blacklock BJ. Biosynthesis and function of polyacetylenes and allied natural products. Progress in Lipid Research. 2008, 47 (4): 233–306. PMC 2515280
 . PMID 18387369. doi:10.1016/j.plipres.2008.02.002.
. PMID 18387369. doi:10.1016/j.plipres.2008.02.002.
- ^ Stryer et al., pp. 329–331
- ^ YashRoy R.C. (1990) Magnetic resonance studies of the dynamic organisation of lipids of chloroplast membranes. Journal of Biosciences, vol. 15(4), pp. 281-288.https://www.researchgate.net/publication/225688482_Magnetic_resonance_studies_of_dynamic_organisation_of_lipids_in_chloroplast_membranes?ev=prf_pub
- ^ Stryer et al., pp. 333–34.
- ^ van Meer G, Voelker DR, Feigenson GW. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 2008, 9 (2): 112–24. PMC 2642958
 . PMID 18216768. doi:10.1038/nrm2330.
. PMID 18216768. doi:10.1038/nrm2330.
- ^ Feigenson GW. Phase behavior of lipid mixtures. Nature Chemical Biology. 2006, 2 (11): 560–63. PMC 2685072
 . PMID 17051225. doi:10.1038/nchembio1106-560.
. PMID 17051225. doi:10.1038/nchembio1106-560.
- ^ Wiggins PM. Role of water in some biological processes. Microbiological Reviews. 1990, 54 (4): 432–49. PMC 372788
 . PMID 2087221.
. PMID 2087221.
- ^ Raschke TM, Levitt M. Nonpolar solutes enhance water structure within hydration shells while reducing interactions between them. Proceedings of the National Academy of Sciences of the United States of America. 2005, 102 (19): 6777–82. PMC 1100774
 . PMID 15867152. doi:10.1073/pnas.0500225102.
. PMID 15867152. doi:10.1073/pnas.0500225102.
- ^ Brasaemle DL. Thematic review series: adipocyte biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis. J. Lipid Res. December 2007, 48 (12): 2547–59 [2014-07-11]. PMID 17878492. doi:10.1194/jlr.R700014-JLR200. (原始内容存档于2010-07-06).
- ^ Stryer et al., p. 619.
- ^ Wang X. Lipid signaling. Current Opinion in Plant Biology. 2004, 7 (3): 329–36. PMID 15134755. doi:10.1016/j.pbi.2004.03.012.
- ^ Dinasarapu AR,Saunders B,Ozerlat I,Azam K, and Subramaniam S. Signaling gateway molecule pages—a data model perspective. Bioinformatics. 2011, 27 (12): 1736–1738. PMC 3106186
 . PMID 21505029. doi:10.1093/bioinformatics/btr190.
. PMID 21505029. doi:10.1093/bioinformatics/btr190.
- ^ Eyster KM. The membrane and lipids as integral participants in signal transduction. Advances in Physiology Education. 2007, 31 (1): 5–16. PMID 17327576. doi:10.1152/advan.00088.2006.
- ^ Hinkovska-Galcheva V, VanWay SM, Shanley TP, Kunkel RG. The role of sphingosine-1-phosphate and ceramide-1-phosphate in calcium homeostasis. Current Opinion in Investigational Drugs. 2008, 9 (11): 1192–205. PMID 18951299.
- ^ Saddoughi SA, Song P, Ogretmen B. Roles of bioactive sphingolipids in cancer biology and therapeutics. Subcellular Biochemistry. Subcellular Biochemistry. 2008, 49: 413–40. ISBN 978-1-4020-8830-8. PMC 2636716
 . PMID 18751921. doi:10.1007/978-1-4020-8831-5_16.
. PMID 18751921. doi:10.1007/978-1-4020-8831-5_16.
- ^ Klein C, Malviya AN. Mechanism of nuclear calcium signaling by inositol 1,4,5-trisphosphate produced in the nucleus, nuclear located protein kinase C and cyclic AMP-dependent protein kinase. Frontiers in Bioscience. 2008, 13 (13): 1206–26 [2014-07-12]. PMID 17981624. doi:10.2741/2756. (原始内容存档于2021-02-07).
- ^ Boyce JA. Eicosanoids in asthma, allergic inflammation, and host defense. Current Molecular Medicine. 2008, 8 (5): 335–49. PMID 18691060. doi:10.2174/156652408785160989.
- ^ Bełtowski J. Liver X receptors (LXR) as therapeutic targets in dyslipidemia. Cardiovascular Therapy. 2008, 26 (4): 297–316. PMID 19035881. doi:10.1111/j.1755-5922.2008.00062.x.
- ^ Indiveri C, Tonazzi A, Palmieri F. Characterization of the unidirectional transport of carnitine catalyzed by the reconstituted carnitine carrier from rat liver mitochondria. Biochim. Biophys. Acta. October 1991, 1069 (1): 110–6. PMID 1932043. doi:10.1016/0005-2736(91)90110-T.
- ^ Parodi AJ, Leloir LF. The role of lipid intermediates in the glycosylation of proteins in the eucaryotic cell. Biochim. Biophys. Acta. April 1979, 559 (1): 1–37. PMID 375981. doi:10.1016/0304-4157(79)90006-6.
- ^ Helenius A, Aebi M. Intracellular functions of N-linked glycans. Science. 2001, 291 (5512): 2364–69. PMID 11269317. doi:10.1126/science.291.5512.2364.
- ^ Nowicki, M. and Frentzen, M. Cardiolipin synthase of Arabidopsis thaliana. FEBS Letters. 2005, 579 (10): 2161–2165. PMID 15811335. doi:10.1016/j.febslet.2005.03.007.
- ^ Nowicki, M. Characterization of the Cardiolipin Synthase from Arabidopsis thaliana. Ph.D. thesis, RWTH-Aachen University. 2006 [2014-07-12]. (原始内容存档于2011-10-05).
- ^ Gohil VM, Greenberg ML. Mitochondrial membrane biogenesis: phospholipids and proteins go hand in hand. Journal of Cell Biology. 2009, 184 (4): 469–72. PMC 2654137
 . PMID 19237595. doi:10.1083/jcb.200901127.
. PMID 19237595. doi:10.1083/jcb.200901127.
- ^ Hoch FL. Cardiolipins and biomembrane function. Biochimica et Biophysica Acta. 1992, 1113 (1): 71–133. PMID 10206472. doi:10.1016/0304-4157(92)90035-9.
- ^ Steroids 互联网档案馆的存档,存档日期2011-10-23.. Elmhurst.edu. Retrieved on 2013-10-10.
- ^ Stryer et al., p. 634.
- ^ Chirala S, Wakil S. Structure and function of animal fatty acid synthase. Lipids. 2004, 39 (11): 1045–53. PMID 15726818. doi:10.1007/s11745-004-1329-9.
- ^ White S, Zheng J, Zhang Y. The structural biology of type II fatty acid biosynthesis. Annual Review of Biochemistry. 2005, 74: 791–831. PMID 15952903. doi:10.1146/annurev.biochem.74.082803.133524.
- ^ Ohlrogge J, Jaworski J. Regulation of fatty acid synthesis. Annual Review of Plant Physiology and Plant Molecular Biology. 1997, 48: 109–136. PMID 15012259. doi:10.1146/annurev.arplant.48.1.109.
- ^ 79.0 79.1 Stryer et al., p. 643.
- ^ Stryer et al., pp. 733–39.
- ^ 81.0 81.1 Kuzuyama T, Seto H. Diversity of the biosynthesis of the isoprene units. Natural Product Reports. 2003, 20 (2): 171–83. PMID 12735695. doi:10.1039/b109860h.
- ^ Grochowski L, Xu H, White R. Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate. Journal of Bacteriology. 2006, 188 (9): 3192–98. PMC 1447442
 . PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
. PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
- ^ Lichtenthaler H. The 1-Dideoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants. Annual Review of Plant Physiology and Plant Molecular Biology. 1999, 50: 47–65. PMID 15012203. doi:10.1146/annurev.arplant.50.1.47.
- ^ 84.0 84.1 Schroepfer G. Sterol biosynthesis. Annual Review of Biochemistry. 1981, 50: 585–621. PMID 7023367. doi:10.1146/annurev.bi.50.070181.003101.
- ^ Lees N, Skaggs B, Kirsch D, Bard M. Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review. Lipids. 1995, 30 (3): 221–26. PMID 7791529. doi:10.1007/BF02537824.
- ^ Stryer et al., pp. 625–26.
- ^ Bhagavan, p. 903.
- ^ Russo GL. Dietary n-6 and n-3 polyunsaturated fatty acids: from biochemistry to clinical implications in cardiovascular prevention. Biochemical Pharmacology. 2009, 77 (6): 937–46. PMID 19022225. doi:10.1016/j.bcp.2008.10.020.
- ^ Bhagavan, p. 388.
- ^ Riediger ND, Othman RA, Suh M, Moghadasian MH. A systemic review of the roles of n-3 fatty acids in health and disease. Journal of the American Dietetic Association. 2009, 109 (4): 668–79. PMID 19328262. doi:10.1016/j.jada.2008.12.022.
- ^ Galli C, Risé P. Fish consumption, omega 3 fatty acids and cardiovascular disease. The science and the clinical trials. Nutrition and Health (Berkhamsted, Hertfordshire). 2009, 20 (1): 11–20. PMID 19326716. doi:10.1177/026010600902000102.
- ^ Micha R, Mozaffarian D. Trans fatty acids: effects on cardiometabolic health and implications for policy. Prostaglandins, Leukotrienes, and Essential Fatty Acids. 2008, 79 (3–5): 147–52. PMC 2639783
 . PMID 18996687. doi:10.1016/j.plefa.2008.09.008.
. PMID 18996687. doi:10.1016/j.plefa.2008.09.008.
- ^ Dalainas I, Ioannou HP. The role of trans fatty acids in atherosclerosis, cardiovascular disease and infant development. International Angiology: a Journal of the International Union of Angiology. 2008, 27 (2): 146–56. PMID 18427401.
- ^ Mozaffarian D, Willett WC. Trans fatty acids and cardiovascular risk: a unique cardiometabolic imprint?. Current Atherosclerosis Reports. 2007, 9 (6): 486–93. PMID 18377789. doi:10.1007/s11883-007-0065-9.
- ^ Astrup A, Dyerberg J, Selleck M, Stender S. Nutrition transition and its relationship to the development of obesity and related chronic diseases. Obesity Review. 2008,. 9 Suppl 1: 48–52. PMID 18307699. doi:10.1111/j.1467-789X.2007.00438.x.
- ^ Astrup A. The role of dietary fat in obesity. Seminars in Vascular Medicine. 2005, 5 (1): 40–47. PMID 15968579. doi:10.1055/s-2005-871740.
- ^ Ma Y.; Olendzki, Barbara C.; Hafner, Andrea R.; Chiriboga, David E.; Culver, Annie L.; Andersen, Victoria A.; Merriam, Philip A.; Pagoto, Sherry L.; et al. Low-carbohydrate and high-fat intake among adult patients with poorly controlled type 2 diabetes mellitus. Nutrition. 2006, 22 (11–12): 1129–1136. PMC 2039705
 . PMID 17027229. doi:10.1016/j.nut.2006.08.006.
. PMID 17027229. doi:10.1016/j.nut.2006.08.006.
- ^ Astrup A. Dietary management of obesity. JPEN Journal of Parenteral and Enteral Nutrition. 2008, 32 (5): 575–77. PMID 18753397. doi:10.1177/0148607108321707.
- ^ Beresford SA, Johnson KC, Ritenbaugh C; et al. Low-fat dietary pattern and risk of colorectal cancer: the Women's Health Initiative Randomized Controlled Dietary Modification Trial. JAMA: the Journal of the American Medical Association. 2006, 295 (6): 643–54. PMID 16467233. doi:10.1001/jama.295.6.643.
- ^ Howard BV, Manson JE, Stefanick ML; et al. Low-fat dietary pattern and weight change over 7 years: the Women's Health Initiative Dietary Modification Trial. JAMA: the Journal of the American Medical Association. 2006, 295 (1): 39–49. PMID 16391215. doi:10.1001/jama.295.1.39.
- ^ Howard BV, Van Horn L, Hsia J; et al. Low-fat dietary pattern and risk of cardiovascular disease: the Women's Health Initiative Randomized Controlled Dietary Modification Trial. JAMA : the Journal of the American Medical Association. 2006, 295 (6): 655–66. PMID 16467234. doi:10.1001/jama.295.6.655.
- ^ Fats and Cholesterol: Out with the Bad, In with the Good — What Should You Eat? – The Nutrition Source — Harvard School of Public Health. [2009-05-12]. (原始内容存档于2011-04-27).
外部链接
[编辑]- 入门
- 脂质相关网站列表 (英文)
- 天然脂质学门户网站 (页面存档备份,存于互联网档案馆) - 近期脂质研究之摘要 (英文)
- 脂质数据库 - 脂质化学与生物化学之文献 (英文)
- Cyberlipid.org (页面存档备份,存于互联网档案馆) - 脂质相关历史与资源 (英文)
- 电脑模拟分子 (页面存档备份,存于互联网档案馆) - 膜脂模型 (英文)
- 脂质、膜和囊泡运输 - 生物化学和细胞生物学的虚拟图书馆 (英文)
- 命名
- IUPAC命名法:脂质 (页面存档备份,存于互联网档案馆) (英文)
- IUPAC词汇表:脂质类分子 (英文)
- 数据库
