三氯氧钒
外观
| 三氯氧钒 | |
|---|---|

| |
| |
| IUPAC名 三氯氧钒 | |
| 别名 | 钒酰氯 |
| 识别 | |
| CAS号 | 7727-18-6 |
| PubChem | 24410 |
| RTECS | YW2975000 |
| 性质 | |
| 化学式 | VOCl3 |
| 摩尔质量 | 173.30 g·mol⁻¹ |
| 外观 | 棕黄色液体 |
| 密度 | 1.826 g/cm3,液态 |
| 熔点 | -76.5 °C(197 K) |
| 沸点 | 126.7 °C(400 K) |
| 溶解性(水) | 分解 |
| 溶解性(其他溶剂) | 含氯溶剂 |
| 蒸气压 | 8.1 Pa(20 °C) |
| 结构 | |
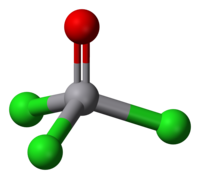
| 分子构型 | 四面体 |
| 危险性 | |
| 欧盟编号 | 没列出 |
| 主要危害 | 有毒,水解生成HCl |
| NFPA 704 | |
| 致死量或浓度: | |
LD50(中位剂量)
|
140 mg/kg(老鼠,口服) |
| 相关物质 | |
| 相关钒化合物 | 五氧化二钒 四氯化钒 三氟氧钒 |
| 相关化学品 | 三氯氧磷 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
三氯氧钒,化学式为VOCl3的无机物。这种物质可通过蒸馏的方法得到,在空气中十分容易水解,是一种强氧化剂。在有机合成中充当反应试剂。[1]
性质
[编辑]三氯氧钒的钒呈正五价,并有反磁性。其分子构形为正四面体,其中O-V-Cl键键角为111°,Cl-V-Cl键键角为108°,V-O键和V-Cl键健长分别为157和214pm。三氯氧钒在水中反应剧烈,静置时会产生氯气。其可溶于非极性溶剂,如苯,二氯甲烷,己烷。在某种程度上,三氯氧钒和三氯氧磷化学性质相似。一个不同点是,三氯氧钒是强氧化剂,而磷化物不是。[2]
制备
[编辑]VOCl3可由V2O5与氯气反应制得,反应过程中,环境温度约保持在600°C:[3]
- 3 Cl2 + V2O5 → 2 VOCl3 + 1.5 O2
当V2O5和碳混合,环境温度在200-400 °C时,碳会充当脱氧剂,就像碳在克罗尔法中将TiO2转化为TiCl4的作用一样。
三氧化二钒也可用作反应前体物:
- 3 Cl2 + V2O3 → 2 VOCl3 + 0.5 O2
- V2O5 + 3 SOCl2 → 2 VOCl3 + 3 SO2
相关反应
[编辑]水解和醇解
[编辑]三氯氧钒在水中会迅速水解为五氧化二钒和盐酸。在化学框模板的最上面一幅图中,可见到在烧杯壁有橙色的V2O5生成。该过程中间会有VO2Cl生成:
- 2 VOCl3 + 3 H2O → V2O5 + 6 HCl
VOCl3可与醇类反应,生成醇盐,特别是在质子接受体(如Et3N)前面:
互换成其他V-O-Cl化合物
[编辑]VOCl3也可用于合成VOCl2:
- V2O5 + 3 VCl3 + VOCl3 → 6 VOCl2
- VOCl3 + Cl2O → VO2Cl + 2 Cl2
大于180°C时,VO2Cl分解为V2O5和VOCl3。同样,VOCl2也可分解为VOCl3和VOCl。
加合物
[编辑]VOCl3是一种强路易斯酸,其趋向于与乙腈、胺等各种碱基形成加合物。在形成的加合物中,钒会由原先的V4几何四面体变为V6八面体:
- VOCl3 + 2 H2NEt → VOCl3(H2NEt)2
VOCl3用于烯烃聚合
[编辑]VOCl3在制备乙丙橡胶(实三元乙丙橡胶,EPDM)的反应中可用作催化剂或预催化剂。
参考来源
[编辑]- ^ M. O'Brien, B. Vanasse. Encyclopedia of Reagents for Organic Synthesis. 2001.
- ^ A. Earnshaw, N. Greenwood. The Chemistry of the Elements - Second Edition. 1997: 513–514.
- ^ A. Holleman, E. Wiberg. Inorganic Chemistry. 2001.
- ^ S. Tyree. Inorganic Syntheses Volume IX. 1967: 80.
- ^ H. Oppermann, "Gleichgewichte mit VOCl3, VO2Cl, VOCl2" Zeitschrift für Anorganische und Allgemeine Chemie, vol. 331. 113-126 (1967)

