巴布勒氧化
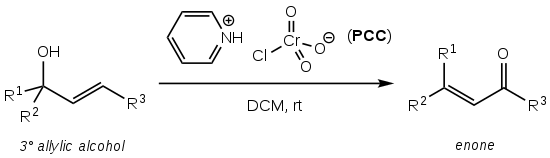
Babler氧化反應(英語:Babler oxidation)也稱作Babler-Dauben氧化反應,是一種使用吡啶氯鉻酸鹽(PCC)直接轉化烯丙基叔醇為相應的α,β-不飽和羰基化合物的有機反應[1]。
詹姆斯·巴布勒(J. H. Babler)和威廉·道本(W. G. Dauben)分別於1976和1977年報導了這一反應[1][2],並將此反應拓展至環狀體系中[1][3],使該反應具有了一定的合成實用性,該反應也以他們二人命名。

該反應的目標α,β-不飽和醛酮產率較高(通常大於75%),操作簡便也無需氣體保護或加熱[1],但所使用的六價鉻氧化劑PCC具有很高的毒性、致癌性和環境危險性。
該反應的溶劑通常是乾燥的二氯甲烷(DCM)或氯仿(CHCl3)[1][2]。該反應為嗎啡全合成中的一步[1][4]。
機理[編輯]
據報導叔醇的Babler氧化反應機理是由烯丙基醇親核進攻鉻酸鹽,形成鉻酸酯(1),然後經過[3,3]-σ遷移重排成異構的鉻酸酯(2)並最終氧化得到α,β-不飽和醛酮(3)[1]。

環保改進[編輯]
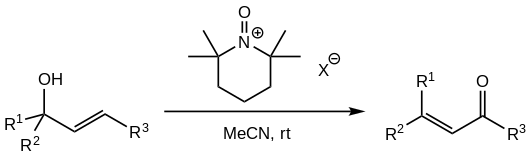
由於PCC氧化劑的高毒性和致癌性,並考慮到鉻(VI)對地下水污染的作用,有研究嘗試在類似反應中替代PCC。有報導成功使用TMP衍生的N-氧代銨鹽進行替代。[1][5] 替代的氧代銨鹽僅可使用帶有非配位陰離子的(如四氟硼酸鹽、高氯酸鹽、六氟磷酸鹽或六氟銻酸鹽)[5],氧化劑按化學計量使用,通常為醇的1.5 eq。
另一種方法是減少反應中鉻(VI)的使用量,如只使用催化量的PCC(5 mol%)和過量的另一種氧化劑作為共氧化劑(co-oxidant)進行反應,此法中已見報告的試劑有二叔丁基過氧化物、2-碘醯基苯甲酸或高碘酸[1]。
對仲醇的氧化[編輯]
相較於叔醇,烯丙基仲醇的Babler-Dauben氧化反應更難控制,會出現裂解的副產物(c)[1]:
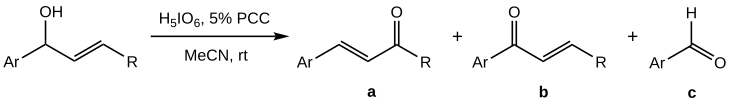
據報導,當PCC不按化學計量投入,而是作為共氧化劑使用時,a的產率將最大化;如果以高碘酸作為主要氧化劑、5 mol%的PCC作為共氧化劑時,效果最好(a產率達50-70%),溶劑選擇乙腈[1]。
與叔醇不同的是,仲醇的Babler氧化只發生在芳基底物(Ar-)或含雜環芳香的結構上,並且考慮到反應中使用的過量高碘酸導致的強酸性條件,仲醇氧化的反應機理被認為是未經過σ遷移重排,而是經由碳正離子中間體進行的。[1]
參見[編輯]
參考文獻[編輯]
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 Killoran, Patrick M.; Rossington, Steven B.; Wilkinson, James A.; Hadfield, John A. Expanding the scope of the Babler–Dauben oxidation: 1,3-oxidative transposition of secondary allylic alcohols. Tetrahedron Letters. 2016-08-31, 57 (35): 3954–3957. ISSN 0040-4039. doi:10.1016/j.tetlet.2016.07.076 (英語).
- ^ 2.0 2.1 Babler, James H.; Coghlan, Michael J. A Facile Method for the Bishomologation of Ketones to α,β-Unsaturated Aldehydes: Application to the Synthesis of the Cyclohexanoid Components of the Boll Weevil Sex Attractant. Synthetic Communications. 1976-01-01, 6 (7): 469–474. ISSN 0039-7911. doi:10.1080/00397917608082626.
- ^ Dauben, William G.; Michno, Drake M. Direct oxidation of tertiary allylic alcohols. A simple and effective method for alkylative carbonyl transposition. The Journal of Organic Chemistry. 1977-03-01, 42 (4): 682–685. ISSN 0022-3263. doi:10.1021/jo00424a023.
- ^ Nagata, Hiroshi; Miyazawa, Norio; Ogasawara, Kunio. A concise route to (−)-morphine. Chemical Communications. 2001-01-01, (12): 1094–1095 [2023-07-25]. ISSN 1364-548X. doi:10.1039/B101668G. (原始內容存檔於2023-07-25) (英語).
- ^ 5.0 5.1 Shibuya, Masatoshi; Tomizawa, Masaki; Iwabuchi, Yoshiharu. Oxidative Rearrangement of Tertiary Allylic Alcohols Employing Oxoammonium Salts. The Journal of Organic Chemistry. 2008-06-01, 73 (12): 4750–4752. ISSN 0022-3263. PMID 18500838. doi:10.1021/jo800634r.
