砷酸鈉
| 砷酸鈉 | |
|---|---|
| |
| IUPAC名 Sodium dihydrogen arsenate | |
| 別名 | sodium arsenate |
| 識別 | |
| CAS號 | 13464-38-5(無水) 13510-46-8(十二水) |
| PubChem | 47275 23622126 57348098 |
| ChemSpider | 43027, 29325835 |
| SMILES |
|
| InChI |
|
| InChIKey | CDBAKLRDFBGJOX-UHFFFAOYSA-K |
| ChEBI | 84070 |
| 性質 | |
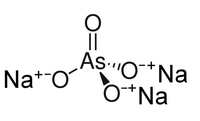
| 化學式 | Na3AsO4 |
| 莫耳質量 | 207.89 g·mol⁻¹ |
| 外觀 | 無色固體 |
| 密度 | 1.517 g/cm3 (十二水) |
| 熔點 | 995—1,005 °C(1,268—1,278 K)(無水)[1] 60 °C(333 K)(十二水,分解)[1] |
| 溶解性(水) | 可溶 |
| 危險性 | |
GHS危險性符號  
| |
| GHS提示詞 | 危險 |
| H-術語 | H301, H331, H350, H410 |
| P-術語 | P201, P202, P261, P264, P270, P271, P273, P281, P301+310, P304+340, P308+313, P311, P321, P330 |
| 主要危害 | 有毒 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
砷酸鈉是一種無機化合物,化學式為Na3AsO4。
製備[編輯]
砷酸鈉可由砷酸(或五氧化二砷[2])和氫氧化鈉反應得到,從pH=11的溶液中可析出十二水合物:
- H3AsO4 + 3 NaOH → Na3AsO4 + 3 H2O
或由偏亞砷酸鈉在水中經過氧化鈉氧化得到。[3]它也可以從紅砷鎳礦中用硝酸鈉和氫氧化鈉提取出來:[4]
- 2 NiAs + 7 NaNO3 + 6 NaOH → 2 NiO + 2 Na3AsO4 + 7 NaNO2 + 3 H2O
性質[編輯]
砷酸鈉和金屬鹽在氨的存在下反應,可以得到相應的氨配鹽[M(NH3)6]AsO4(M=Sc, Y, La, Cr, Co, Fe)。[5]它可以被甲醛還原為單質砷。[6]
參考文獻[編輯]
- ^ 1.0 1.1 Buketov, E. A.; Polukarov, A. N.; Isabaev, S. M.; Zhambekov, M. I. Thermal stability of sodium arsenates. Vestnik Akademii Nauk Kazakhskoi SSR, 1973. 29 (6): 30-33. ISSN: 0002-3213.
- ^ Sagadieva, A. K.; Makhmetov, M. Zh.; Kozorin, L. G. Crystal hydrates of sodium arsenate (Na3AsO4). Zhurnal Neorganicheskoi Khimii, 1980. 25 (4): 1129-1132. ISSN: 0044-457X.
- ^ Chavchanidze, N. G.; Giuashvili, I. I.; Ugulava, M. M.; Gigauri, R. D. Preparation of alkali metal arsenates. Zhurnal Neorganicheskoi Khimii, 1990. 35 (4): 1074-1076. ISSN: 0044-457X.
- ^ Fester, G. A. Sodium arsenate from nickel arsenides. Rev. fac. ing. quim., 1956. 25: 143-151. CAN52: 10344.
- ^ Kekenadze, M.; Rusia, M.; Kutsia, L.; Dzotsenidze, Z.; Gigauri, R. Synthesis and study of ammines of d-metals' (III) tetraoxoarsenates. Bulletin of the Georgian Academy of Sciences, 2000. 162 (2): 265-268. ISSN: 1560-0262.
- ^ Bugenov, E. S.; Savel'ev, A. E. Mechanism of homogeneous reduction of arsenate ions with Formalin. Kompleksnoe Ispol'zovanie Mineral'nogo Syr'ya, 1979. 4: 22-28. ISSN: 0202-1382.
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
