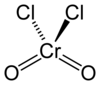
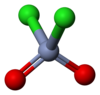
鉻醯氯
| 鉻醯氯 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Chromium(VI) dichloride dioxide 二氯二氧化鉻(VI) | |||
| 別名 | 氧氯化鉻、氧化鉻氯、氯化鉻醯 | ||
| 識別 | |||
| CAS號 | 14977-61-8 | ||
| ChemSpider | 21106426 | ||
| InChI |
| ||
| InChIKey | AHXGRMIPHCAXFP-UHFFFAOYSA-L | ||
| EINECS | 239-056-8 | ||
| ChEBI | 33038 | ||
| RTECS | GB5775000 | ||
| 性質 | |||
| 化學式 | CrO2Cl2 | ||
| 莫耳質量 | 154.9008 g·mol⁻¹ | ||
| 外觀 | 深紅色發煙液體 | ||
| 密度 | 1.911 g/mL(液) | ||
| 熔點 | -96.5℃ | ||
| 沸點 | 117℃ | ||
| 溶解性(水) | 分解 | ||
| 危險性 | |||
| 警示術語 | R:R8, R35 R43, R46, R49, R50/53 | ||
| 安全術語 | S:S45, S53, S60, S61 | ||
| 相關物質 | |||
| 相關化學品 | 硫醯氯、三氯氧釩、 二氯二氧化鉬、 二氯二氧化鎢 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
鉻醯氯(英語:Chromyl Chloride)是一種無機化合物,化學式為CrO2Cl2。它是一種暗紅色有刺鼻氣味的液體,遇水劇烈分解,在空氣中發煙。能溶於氯仿、苯、二硫化碳、四氯化碳、三氯氧磷。具強氧化性,是有機合成試劑,也用作溶劑。會腐蝕橡膠和大部分塑料。
製備[編輯]
由三氧化鉻與氯化氫反應得到。一般用重鉻酸鉀/鉻酸鉀與濃鹽酸反應,並加入硫酸作脫水劑。反應後的反應液出現分層,密度較大的鉻醯氯為下層,用分液或分餾的方法即可分離出來。[1]
鉻醯氯也可由重鉻酸鉀分別與五氯化磷、四氯化鈦、氯磺酸或濃硫酸+氯化鈉作用得到。[2]
性質[編輯]
為四面體型分子,鉻原子位於中心,為VI氧化態(+6)。氧化性比鉻酸根離子更強。具很強的親電性。
與無定形硫混合發生自燃。遇水迅速發生水解,生成鹽酸和鉻酸,液體在潮濕空氣中發煙。
上文中用濃硫酸、重鉻酸鉀與氯化物作用製取鉻醯氯的反應可用於樣品中氯化物的鑑定。若樣品與濃硫酸、重鉻酸鉀混合後共熱時,產生紅色的鉻醯氯煙霧,即可證明樣品中氯離子的存在。氟化物、溴化物、碘化物和氰化物對反應均不產生干擾。
鉻醯氯可將末端烯烴氧化為醛,將非末端烯烴氧化為α-氯代酮及衍生物,[3]以及將與芳環相連的甲基氧化為醛基(Étard反應)。也稱Étard試劑。二氯甲烷是常用的反應溶劑。此類型的有機合成試劑還有三氯氧釩、四氯化鈦及硫醯氯。
危險性[編輯]
主要通過吸入的方式進入人體,具強致癌性,[4]會導致染色體異常,長期與皮膚接觸會導致皮膚潰瘍。[5]
對眼睛、皮膚、呼吸道和黏膜具強烈刺激作用,急性吸入可能因支氣管和咽喉的痙攣、炎症、水腫、化學性肺炎、肺水腫而致死。[5]
參考資料[編輯]
- ^ Sisler, H. H. "Chromyl Chloride" Inorganic Synthesis McGraw-Hill: New York, 1946; Vol. 2, pp 205–207.
- ^ Moody, B.J. 22. Comparative Inorganic Chemistry 1. London: Edward Arnold. : 381 [1965] (英語).
- ^ F. Freeman, R. H. DuBois, T. G. McLaughlin. "Aldehydes by Oxidation of Terminal Olefins with Chromyl Chloride: 2,4,4-Trimethylpentanal". Org. Synth.; Coll. Vol. 6: 1028.
- ^ IARC. Volume 49: Chromium, Nickel, and Welding (PDF). 1999-11-05: 21–23 [1990] [2008-03-26]. ISBN 92-832-1249-5. (原始內容 (PDF)存檔於2008-12-24).
- ^ 5.0 5.1 Prof CH Gray (編). IV. Laboratory Handbook of Toxic Agents 2. London: Royal Institute of Chemistry. : 79 [1966] (英語).
- F. Freeman "Chromyl Chloride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||